题目内容
13.现有金属单质A、B、C和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).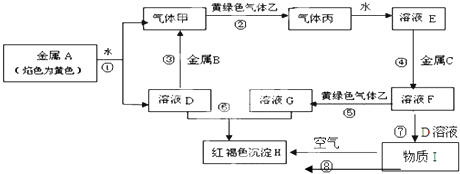
请根据以上信息回答下列问题:
(1)金属A的化学式为Na;
(2)实验室检验G中所含的金属离子时,常在G的溶液中加入(填试剂名称)KSCN溶液;
(3)反应④的离子方程式为Fe+2H+═Fe2++2H2 ↑;
(4)反应⑧的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,氯化亚铁与氢氧化钠反应生成I为Fe(OH)2,氢氧化亚铁在空气中被氧化成氢氧化铁,符合各物质的转化关系,据此答题;
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,氯化亚铁与氢氧化钠反应生成I为Fe(OH)2,氢氧化亚铁在空气中被氧化成氢氧化铁,
(1)根据上面的分析可知,金属A的化学式为Na,
故答案为:Na;
(2)G为FeCl3,实验室检验G中所含的铁离子时,常用KSCN溶液,溶液呈血红色,
故答案为:KSCN;
(3)反应④为盐酸与铁的反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+═Fe2++2H2 ↑,
故答案为:Fe+2H+═Fe2++2H2 ↑;
(4)反应⑧为氢氧化亚铁在空气中被氧化成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
点评 本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
①分子式符合CxH2x+2Oy
②相对分子质量介于70~100
③氧元素的质量分数为18.18%
④分子中含有2个甲基
⑤能与金属钠反数应放出氢气.
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | Na与水反应 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | CO2通入过量澄清石灰水 CO2+Ca2++2OH-═CaCO3↓+H2O |
| A. | 氢氧化铝:治疗胃酸过多的一种药剂 | |
| B. | 明矾:净水剂 | |
| C. | 烧碱:治疗胃酸过多的一种药剂 | |
| D. | 小苏打:发酵粉主要成分 |
| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?

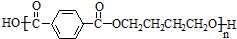
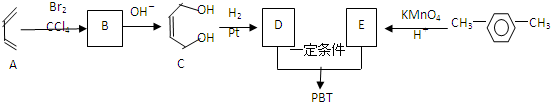
 互为同系物关系.
互为同系物关系.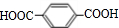 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$