题目内容
12.胃酸过多是常见的胃病,下面是甲、乙两种常见胃药的说明摘要.甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;④遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起胃溃疡穿孔的危险;(6)焰色反应为黄色.
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液中.
(1)请你推测,甲中含有的主要化学成分是NaHCO3(填化学式,下同);乙中含有的主要化学成分是Al(OH)3.
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式HCO3-+H+=CO2↑+H2O
(3)试写出乙溶于NaOH溶液的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 甲、乙两种常见胃药,甲是白色结晶状粉末,能溶于水,水溶液呈弱碱性,受热分解,遇酸及酸性药物则产生二氧化碳,胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险,则甲为NaHCO3;
乙与胃酸的中和作用缓慢持久,凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+,可溶于稀酸或氢氧化钠溶液,则乙为Al(OH)3,据此解答.
解答 解:甲、乙两种常见胃药,甲是白色结晶状粉末,能溶于水,水溶液呈弱碱性,受热分解,遇酸及酸性药物则产生二氧化碳,胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险,则甲为NaHCO3;
乙与胃酸的中和作用缓慢持久,凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+,可溶于稀酸或氢氧化钠溶液,则乙为Al(OH)3,
(1)甲中含有的主要化学成分是NaHCO3;乙中含有的主要化学成分是Al(OH)3,
故答案为:NaHCO3;Al(OH)3;
(2)胃酸主要成份为元素,碳酸氢钠与盐酸反应生成二氧化碳,引起胃胀气,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
(3)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素化合物推断、常用化学用语,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
3.某同学取不同质量的镁铝合金样品分别与30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
通过计算求:
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
7.为了除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )
①饱和的Na2CO3溶液 ②饱和的NaHCO3溶液 ③浓硫酸 ④灼热的铜网 ⑤碱石灰.
①饱和的Na2CO3溶液 ②饱和的NaHCO3溶液 ③浓硫酸 ④灼热的铜网 ⑤碱石灰.
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
17.下列物质的俗称与化学式对应一致的是( )
| A. | 纯碱NaOH | B. | 硫黄SO3 | C. | 铁红Fe2O3 | D. | 苏打NaHCO3 |
4.实验室中下列药品的保存方法,正确的是( )
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
1.已知 298K 时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,推测含 1molCH3COOH 的稀溶液与含 1mol NaOH 的稀溶液反应放出的热量( )
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
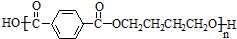
 互为同系物关系.
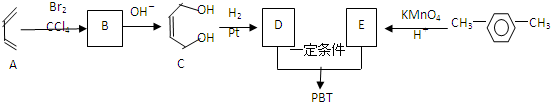
互为同系物关系.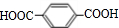 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$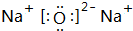 .
.