题目内容
13.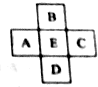 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
分析 如果D与E、E与D相差原子序数相同时,四种元素的原子序数之和为4x;
如果E是第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8;
如果E是第四周期Ca元素,D和E原子序数相差8,B和E原子序数相差18;
如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18;
如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,据此进行解答.
解答 解:如果D与E、E与D相差原子序数相同时,则A、B、C、D四种元素的原子序数之和为4x;
如果E为第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8,则A、B、C、D四种元素的原子序数之和为4x+10;
如果E是第四周期Ca元素,B和E原子序数相差8,D和E原子序数相差18,则A、B、C、D四种元素的原子序数之和为4x+10;
如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18,A、B、C、D四种元素的原子序数之和为4x;
如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,则A、B、C、D四种元素的原子序数之和为4x+14,
通过以上分析知,A、B、C、D四种元素原子序数之和不可能为4x+6,
故选B.
点评 本题考查元素周期表结构及元素在周期表中的位置,题目难度中等,试题侧重考查学生分析问题能力、发散思维能力,采用假设方法对元素进行分析,注意同一主族相邻元素原子序数之差.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
3.某同学取不同质量的镁铝合金样品分别与30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
通过计算求:
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
4.实验室中下列药品的保存方法,正确的是( )
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
1.已知 298K 时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,推测含 1molCH3COOH 的稀溶液与含 1mol NaOH 的稀溶液反应放出的热量( )
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
8.下列反应达到平衡后,升高温度,可使混合气的平均摩尔质量增大的是( )
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
6.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
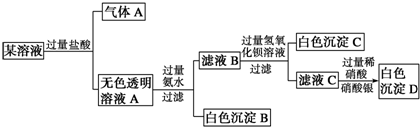
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
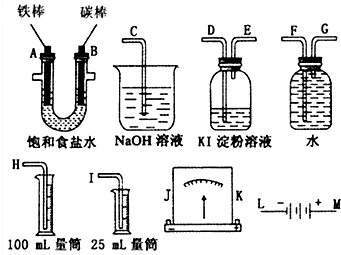 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.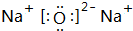 .
.