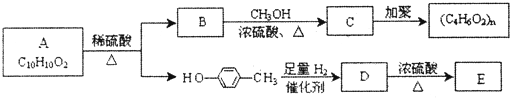
题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=
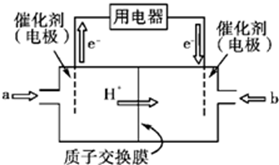
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| 一定条件 |
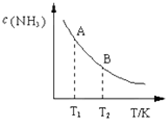
(3)在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N2的浓度为
②图中在状态A时,平衡常数 KA=
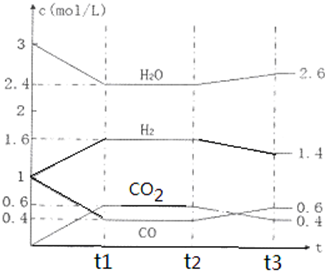
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
a.使用催化剂
b.降低温度
c.增加H2的浓度
d.充入Ne增大压强.
考点:用盖斯定律进行有关反应热的计算,化学平衡常数的含义,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律书写二氧化氮转化为氮气的热化学方程式,从而计算反应热;
(2)燃料电池中,正极上氧化剂得电子发生还原反应;
(3)①在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,设参加反应的氮气的物质的量为x,
N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
反应xmol 3xmol 2xmol
平衡(1-x)mol 3(1-x)mol 2xmol
根据
×100%=25%,x=0.4mol,
根据C=
计算A点氮气浓度;
②根据平衡时各物质浓度计算化学平衡常数,升高温度平衡向吸热反应方向移动,据此确定平衡常数变化;
③0-6min时,氮气浓度减小、氨气浓度增大,平衡向正反应方向移动,如果氨气浓度增大0.48mol/L,氢气浓度应该减少0.72mol/L,改变的条件不是增加氢气浓度.
(2)燃料电池中,正极上氧化剂得电子发生还原反应;
(3)①在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,设参加反应的氮气的物质的量为x,
N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
反应xmol 3xmol 2xmol
平衡(1-x)mol 3(1-x)mol 2xmol
根据
| 2x |
| (1-x)mol+3(1-x)mol+2xmol |
根据C=
| n |
| V |
②根据平衡时各物质浓度计算化学平衡常数,升高温度平衡向吸热反应方向移动,据此确定平衡常数变化;
③0-6min时,氮气浓度减小、氨气浓度增大,平衡向正反应方向移动,如果氨气浓度增大0.48mol/L,氢气浓度应该减少0.72mol/L,改变的条件不是增加氢气浓度.
解答:
解:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2②
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,
将热化学方程式
得热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=
kJ/mol=-867kJ/mol,△H2=-1160kJ/mol,
故答案为:-1160kJ/mol;
(2)燃料电池中,正极上氮气得电子和氢离子发生还原反应生成氨气,电极反应式为N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(3)①在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,设参加反应的氮气的物质的量为x,
N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
反应xmol 3xmol 2xmol
平衡(1-x)mol 3(1-x)mol 2xmol
根据
×100%=25%,x=0.4mol,
平衡时氮气的物质的量=1mol-0.4mol=0.6mol,氮气的平衡浓度C=
=
=0.06mol/L,
故答案为:0.06;
②平衡时,C(N2)=0.06mol/L、C(H2)=
=0.18mol/L、C(NH3)=
=0.08mol/L,平衡常数K=
;
升高温度,氨气含量减少,说明平衡向逆反应方向移动,则正反应是放热反应,化学平衡常数减小,即KA>KB,
故答案为:
;>;
③0-6min时,氮气浓度减小、氨气浓度增大,平衡向正反应方向移动,如果氨气浓度增大0.48mol/L,氢气浓度应该减少0.72mol/L,改变的条件不是增加氢气浓度,
第一个3min氨气浓度改变量小于第二个3min浓度改变量,说明反应速率增大但平衡不移动,
a.第一个3min氨气浓度改变量小于第二个3min浓度改变量,说明反应速率增大但平衡不移动,使用催化剂可以实现,故正确;
b.降低温度反应速率减小且平衡向正反应方向移动,不符合条件,故错误;
c.增加H2的浓度时,第二个3min氢气浓度应该大于1.08mol/L,故错误;
d.充入Ne增大压强,氮气、氢气、氨气浓度不变,反应速率不变,不符合条件,故错误;
故选a.
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2②
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,
将热化学方程式
| ①+② |
| 2 |
| -574+△H2 |
| 2 |
故答案为:-1160kJ/mol;
(2)燃料电池中,正极上氮气得电子和氢离子发生还原反应生成氨气,电极反应式为N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(3)①在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,设参加反应的氮气的物质的量为x,
N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
反应xmol 3xmol 2xmol
平衡(1-x)mol 3(1-x)mol 2xmol
根据
| 2x |
| (1-x)mol+3(1-x)mol+2xmol |
平衡时氮气的物质的量=1mol-0.4mol=0.6mol,氮气的平衡浓度C=
| n |
| V |
| 0.6mol |
| 10L |
故答案为:0.06;
②平衡时,C(N2)=0.06mol/L、C(H2)=
| 3(1-0.4)mol |
| 10L |
| 2×0.4mol |
| 10L |
| 0.08×0.08 |
| (0.18)3×0.06 |
升高温度,氨气含量减少,说明平衡向逆反应方向移动,则正反应是放热反应,化学平衡常数减小,即KA>KB,
故答案为:
| 0.08×0.08 |
| (0.18)3×0.06 |
③0-6min时,氮气浓度减小、氨气浓度增大,平衡向正反应方向移动,如果氨气浓度增大0.48mol/L,氢气浓度应该减少0.72mol/L,改变的条件不是增加氢气浓度,
第一个3min氨气浓度改变量小于第二个3min浓度改变量,说明反应速率增大但平衡不移动,
a.第一个3min氨气浓度改变量小于第二个3min浓度改变量,说明反应速率增大但平衡不移动,使用催化剂可以实现,故正确;
b.降低温度反应速率减小且平衡向正反应方向移动,不符合条件,故错误;
c.增加H2的浓度时,第二个3min氢气浓度应该大于1.08mol/L,故错误;
d.充入Ne增大压强,氮气、氢气、氨气浓度不变,反应速率不变,不符合条件,故错误;
故选a.
点评:本题考查较综合,涉及化学平衡移动、平衡常数的计算、原电池原理、盖斯定律等知识点,这些知识点都是考试热点,难点是平衡移动的判断、平衡常数的计算等,平衡常数的计算中必须用平衡时物质浓度而不是任意时刻物质浓度,为易错点.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列说法中错误的是( )
| A、用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素 |
| B、焰色反应能用来鉴别所有金属元素 |
| C、用原子吸收光谱确定物质中含有哪些金属元素 |
| D、层析法利用了混合物中各物质被吸附性能的不同 |
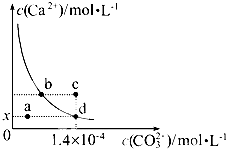 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
下列离子方程式涉及的反应属于氧化还原反应的是( )
| A、Ba2++SO42-═BaSO4↓ |
| B、Fe+2H+═Fe2++H2↑ |
| C、Al2O3+6H+═2Al3++3H2O |
| D、HCO3-+OH-═CO32-+H2O |
 [化学一选修/有机化学基础]
[化学一选修/有机化学基础]