题目内容
盐酸是中学阶段常见的强酸
(1)图1各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有 .
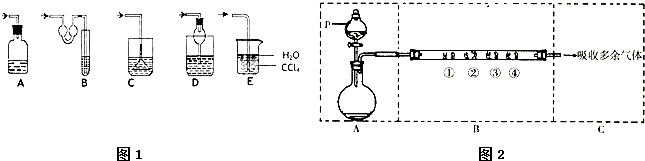
(2)用图2装置可以完成HCl的制取及后续一系列的性质实验(图中夹持装置已略去).请回答下列问题:
(a)装置A选用浓硫酸和浓盐酸混合制取HCl气体,p中盛装试剂为 .
(b)装置B中的四处棉花依次做了如下处理:①包有某潮湿的固体物质 ②蘸有KI溶液③蘸有石蕊溶液 ④蘸有浓NaOH溶液.反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 .在①处包有的固体物质可能是
a.MnO2 b.KMnO4 C.KCl d.Cu.
(1)图1各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有

(2)用图2装置可以完成HCl的制取及后续一系列的性质实验(图中夹持装置已略去).请回答下列问题:
(a)装置A选用浓硫酸和浓盐酸混合制取HCl气体,p中盛装试剂为
(b)装置B中的四处棉花依次做了如下处理:①包有某潮湿的固体物质 ②蘸有KI溶液③蘸有石蕊溶液 ④蘸有浓NaOH溶液.反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
a.MnO2 b.KMnO4 C.KCl d.Cu.
考点:制备实验方案的设计,实验装置综合
专题:实验设计题
分析:(1)HCl极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象,则具有缓冲装置或气体与水不能直接接触的可具有防止倒吸的作用;
(2)(a)装置A选用浓硫酸和浓盐酸混合制取HCl气体,结合浓硫酸的密度比盐酸大,且浓硫酸稀释放出大量的热来分析;
(b)观察到②处有棕黄色物质产生,生成碘单质,则①处物质与HCl反应生成氯气,氯气有强氧化性,能和②中碘离子发生氧化还原反应,以此啦解答.
(2)(a)装置A选用浓硫酸和浓盐酸混合制取HCl气体,结合浓硫酸的密度比盐酸大,且浓硫酸稀释放出大量的热来分析;
(b)观察到②处有棕黄色物质产生,生成碘单质,则①处物质与HCl反应生成氯气,氯气有强氧化性,能和②中碘离子发生氧化还原反应,以此啦解答.
解答:
解:(1)A.吸收装置中的导管没直接伸入到液体中,不易吸收气体,且装置密封,气体体积过大时易发生炸裂,故A错误;
B.吸收装置中的导管外联双球状导管内伸入到液体中,具有缓冲作用,能防止倒吸,故B正确;
C.吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故C错误;
D.球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,故D正确;
E.水的密度比四氯化碳小且水和四氯化碳不互溶,所以水浮在四氯化碳的上面,四氯化碳不能和氯化氢反应,也不溶解氯化氢,该装置既能够吸收易溶性气体,又能够防止倒吸,故E正确;
故答案为:BDE;
(2)(a)浓硫酸有吸水性,吸收浓盐酸中的水分而促进浓盐酸的挥发,浓硫酸稀释时放出热量,也促进浓盐酸的挥发,结合A装置可知,浓硫酸的密度比盐酸大,只能是浓硫酸加入到稀盐酸中,则分液漏斗p中装的试剂为浓硫酸,故答案为:浓硫酸;
(b)反应开始后,观察到②处棉花变成棕黄色,说明有碘单质生成,所以①有氯气生成,KMnO4有强氧化性,氯化氢有还原性,所以氯化氢和高锰酸钾能发生氧化还原反应生成氯气,KCl、Cu与HCl不反应;氯气有强氧化性,能和碘离子发生置换反应生成碘单质,离子反应方程式为Cl2+2I-=I2+2Cl-,
故答案为:Cl2+2I-=I2+2Cl-;b.
B.吸收装置中的导管外联双球状导管内伸入到液体中,具有缓冲作用,能防止倒吸,故B正确;
C.吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故C错误;
D.球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,故D正确;
E.水的密度比四氯化碳小且水和四氯化碳不互溶,所以水浮在四氯化碳的上面,四氯化碳不能和氯化氢反应,也不溶解氯化氢,该装置既能够吸收易溶性气体,又能够防止倒吸,故E正确;
故答案为:BDE;
(2)(a)浓硫酸有吸水性,吸收浓盐酸中的水分而促进浓盐酸的挥发,浓硫酸稀释时放出热量,也促进浓盐酸的挥发,结合A装置可知,浓硫酸的密度比盐酸大,只能是浓硫酸加入到稀盐酸中,则分液漏斗p中装的试剂为浓硫酸,故答案为:浓硫酸;
(b)反应开始后,观察到②处棉花变成棕黄色,说明有碘单质生成,所以①有氯气生成,KMnO4有强氧化性,氯化氢有还原性,所以氯化氢和高锰酸钾能发生氧化还原反应生成氯气,KCl、Cu与HCl不反应;氯气有强氧化性,能和碘离子发生置换反应生成碘单质,离子反应方程式为Cl2+2I-=I2+2Cl-,
故答案为:Cl2+2I-=I2+2Cl-;b.
点评:本题考查HCl的制取、性质实验及防倒吸装置,为高频考点,把握浓硫酸的性质及(2)中装置A生成HCl的原理为解答的关键,注意氧化还原反应的应用,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
下列设备工作时,将化学能转化为热能的是( )
A、 硅太阳能电池 |
B、 锂离子电池 |
C、 太阳能集热器 |
D、 燃气炉 |
实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL)
关于以上实验的说法正确是( )
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
有关AgCl沉淀的溶解平衡说法正确的是( )
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
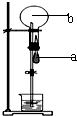 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题: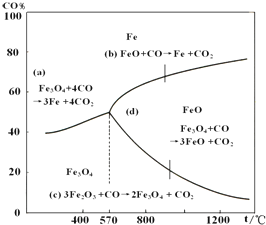 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图: