题目内容
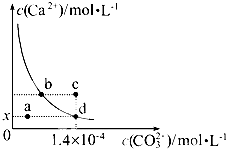 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:CaCO3在水中的沉淀溶解平衡为CaCO3(s)?Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题.
解答:
解:A.d点为饱和溶液,加入蒸馏水后如仍为饱和溶液,则c(Ca2+)、c(CO32-)都不变,如为不饱和溶液,则二者浓度都减小,故不可能使溶液由d点变成a点,故A错误;
B.在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,故B正确;
C.在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故C正确;
D.b点与d点在相同的温度下,溶度积相等,故D正确.
故选A.
B.在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,故B正确;
C.在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故C正确;
D.b点与d点在相同的温度下,溶度积相等,故D正确.
故选A.
点评:本题考查难溶电解质的溶解平衡及沉淀转化等问题,侧重于学生对数据的分析能力的考查,注意分析图象中曲线的变化特点,把握溶度积常数的意义.

练习册系列答案
相关题目
将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20ml0.01mol∕LKCl溶液;
②20ml0.02mol∕LCaCl2溶液;
③20ml蒸馏水;
④20ml0.03mol∕LHCl溶液;
⑤20ml0.05mol∕L AgNO3溶液.
①20ml0.01mol∕LKCl溶液;
②20ml0.02mol∕LCaCl2溶液;
③20ml蒸馏水;
④20ml0.03mol∕LHCl溶液;
⑤20ml0.05mol∕L AgNO3溶液.
| A、①>②>④>③>⑤ |
| B、③>①>④>②>⑤ |
| C、⑤>③>②>①>④ |
| D、③>④>⑤>②>① |
实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL)
关于以上实验的说法正确是( )
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
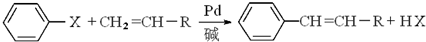 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题: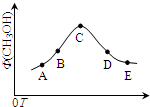 火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.
火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.