题目内容
 [化学一选修/有机化学基础]
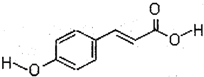
[化学一选修/有机化学基础](1)在液晶显示器工业中广泛应用一种有机物分子对羟基肉桂酸,它是一种强效的导电材料,结构简式如图:
①该有机物的分子中所含官能团的名称
②该有机物能发生的反应类型是(填写代号)
A.氧化反应 B.消去反应 C.加聚反应 D.水解反应
③一定条件下,1mol该有机物分子与溴水完全反应时,最多需要
(2)芳香族化合物C10H10O2有如下的转化关系:
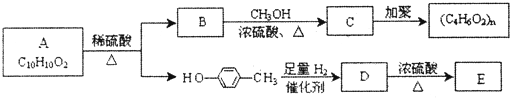
已知E能使Br2的CCl4溶液褪色.
请回答下列问题:
①分别写出A、E的结构简式:A
②若有机物F与C互为同分异构体,则与有机物B互为同系物的F的同分异构体有
③写出B→C反应的化学方程式:
考点:有机物的推断
专题:有机物的化学性质及推断
分析:(1)①由对羟基肉桂酸的结构简式可知,含有酚羟基、羧基、碳碳双键三种官能团;
②该有机物含有酚羟基,具有酚的性质,含有羧基,具有羧酸的性质,含有碳碳双键,具有烯烃的性质;苯环与碳碳双键可以与氢气发生加成反应;
③碳碳双键能与溴发生加成反应,酚羟基的邻位可以与溴发生取代反应;
(2) 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为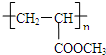 ,据此解答.
,据此解答.
②该有机物含有酚羟基,具有酚的性质,含有羧基,具有羧酸的性质,含有碳碳双键,具有烯烃的性质;苯环与碳碳双键可以与氢气发生加成反应;
③碳碳双键能与溴发生加成反应,酚羟基的邻位可以与溴发生取代反应;
(2)
 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为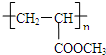 ,据此解答.
,据此解答.解答:
解:(1)①由对羟基肉桂酸的结构简式可知,含有酚羟基、羧基、碳碳双键三种官能团,故答案为:酚羟基、羧基、碳碳双键;
②该有机物含有酚羟基,含有碳碳双键,能发生氧化反应,含有碳碳双键,可以发生加聚反应,不能发生消去反应与水解反应,故答案为:AC;
③碳碳双键能与溴发生加成反应,酚羟基的邻可以与溴发生取代反应,1mol该有机物分子与溴水完全反应时,最多需要3mol Br2,故答案为:3;
(2) 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为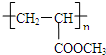 ,
,
①由上述分析可知,A为 ,E为
,E为 ,故答案为:
,故答案为: ;
; ;
;
②若有机物F与C(CH2=CH-COOCH3)互为同分异构体,则与有机物B(CH2=CH-COOH)互为同系物的F的同分异构体有:CH2=CHCH2COOH、CH3CH=CHCOOH、CH2C(CH3)COOH,故答案为:3;
③B→C反应的化学方程式:CH2=CH-COOH+CH3OH
CH2=CH-COOCH3+H2O,
故答案为:CH2=CH-COOH+CH3OH
CH2=CH-COOCH3+H2O.
②该有机物含有酚羟基,含有碳碳双键,能发生氧化反应,含有碳碳双键,可以发生加聚反应,不能发生消去反应与水解反应,故答案为:AC;
③碳碳双键能与溴发生加成反应,酚羟基的邻可以与溴发生取代反应,1mol该有机物分子与溴水完全反应时,最多需要3mol Br2,故答案为:3;
(2)
 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为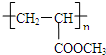 ,
,①由上述分析可知,A为
 ,E为
,E为 ,故答案为:
,故答案为: ;
; ;
;②若有机物F与C(CH2=CH-COOCH3)互为同分异构体,则与有机物B(CH2=CH-COOH)互为同系物的F的同分异构体有:CH2=CHCH2COOH、CH3CH=CHCOOH、CH2C(CH3)COOH,故答案为:3;
③B→C反应的化学方程式:CH2=CH-COOH+CH3OH
| 浓硫酸 |
| △ |
故答案为:CH2=CH-COOH+CH3OH
| 浓硫酸 |
| △ |
点评:本题考查有机物的推断、官能团结构与性质、同分异构体等,掌握官能团的性质是关键,注意根据对甲基苯酚的结构与反应条件进行推断,为高考常见题型,难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
下列设备工作时,将化学能转化为热能的是( )
A、 硅太阳能电池 |
B、 锂离子电池 |
C、 太阳能集热器 |
D、 燃气炉 |
将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20ml0.01mol∕LKCl溶液;
②20ml0.02mol∕LCaCl2溶液;
③20ml蒸馏水;
④20ml0.03mol∕LHCl溶液;
⑤20ml0.05mol∕L AgNO3溶液.
①20ml0.01mol∕LKCl溶液;
②20ml0.02mol∕LCaCl2溶液;
③20ml蒸馏水;
④20ml0.03mol∕LHCl溶液;
⑤20ml0.05mol∕L AgNO3溶液.
| A、①>②>④>③>⑤ |
| B、③>①>④>②>⑤ |
| C、⑤>③>②>①>④ |
| D、③>④>⑤>②>① |
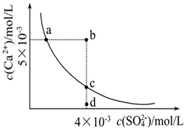 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL)
关于以上实验的说法正确是( )
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
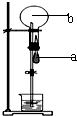 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
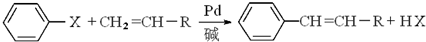 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)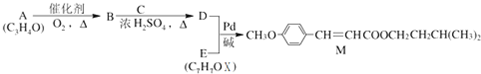
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题: