题目内容
5.下列解释事实的方程式正确的是( )| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.硅酸钠为易溶的强电解质,离子方程式中应该拆开;
C.铝与氧化铁能够发生置换反应生成铁和氧化铝;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.醋酸不能拆开,正确的离子方程式为:CH3COOH+OH-═H2O+CH3COO-,故A错误;
B.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故B错误;
C.利用铝热反应焊接钢轨,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故C正确;
D.用氯水除去FeCl2溶液中的Fe2+,亚铁离子被氧化成铁离子,正确的离子方程式为:Cl2+2Fe2+═2Cl-+2Fe3+,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
14.下列数量的物质中含对应微粒数目最多的是( )
| A. | 0.8molNaCl所含离子数 | B. | 标准状况下5.6L CO2所含原子数 | ||
| C. | 1L1 mol•L-1盐酸溶液所含H原子数 | D. | 10g氖气所含原子数 |
15.下列物质属于电解质的是( )
| A. | 石墨 | B. | 烧碱溶液 | C. | 铜 | D. | 氯化钠晶体 |
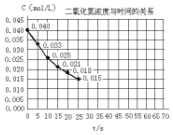 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.