题目内容
16.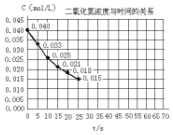 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.(1)前20秒内氧气的平均生成速率5.5×10-4mol/(L•S)
(2)在某温度下达到平衡时的平衡常数表达式是$\frac{{c}^{2}(NO)c({O}_{2})}{{c}^{2}(N{O}_{2})}$.
(3)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是正反应方向,NO2的平衡转化率<68.75%(填“>”、“<”或“=”),NO的体积百分含量减小(填“增大”、“减小”或“不 变”).
(4)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线.
分析 (1)由图可知,20秒内NO2的浓度变化为0.04mol/L-0.018mol/L=0.022mol/L,根据v=$\frac{△c}{△t}$计算v(NO2),再利用速率之比等于化学计量数之比计算v(O2);
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L),图象分析可知,二氧化氮起始浓度0.04mol/L,结合三行计算列式得到,
2NO2?2NO+O2,
起始量(mol/L) 0.04 0 0
变化量(mol/L) 0.0275 0.0275 0.01375
平衡量(mol/L) 0.0125 0.0275 0.01375
在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,增大压强平衡正向进行,但加入量多于平衡移动减小的量,二氧化氮转化率减小,NO含量减小;
(4)若在反应开始时加入催化剂(其他条件都不变),反应速率加快,相同时间内NO2浓度变化量增大,到达平衡时间缩短,但不影响平衡移动,达到平衡是NO2浓度约为0.0125mol/L,据此用虚线画出加催化剂后的反应进程曲线.
解答 解:(1)由图可知,20秒内NO2的浓度变化为0.04mol/L-0.018mol/L=0.022mol/L,故v(NO2)$\frac{0.022mol/L}{20s}$=0.0011mol/(L•s),对于2NO2?2NO+O2,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO2)=$\frac{1}{2}$×0.0011mol/(L•s)=5.5×10-4mol/(L•s),
故答案为:5.5×10-4;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,对于可逆反应2NO2?2NO+O2的平衡常数k=$\frac{{c}^{2}(NO)c({O}_{2})}{{c}^{2}(N{O}_{2})}$,
故答案为:$\frac{{c}^{2}(NO)c({O}_{2})}{{c}^{2}(N{O}_{2})}$;
(3)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L),图象分析可知,二氧化氮起始浓度0.04mol/L,结合三行计算列式得到,
2NO2?2NO+O2,
起始量(mol/L) 0.04 0 0
变化量(mol/L) 0.0275 0.0275 0.01375
平衡量(mol/L) 0.0125 0.0275 0.01375
在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,增大压强平衡正向进行,但加入量多于平衡移动减小的量,二氧化氮转化率减小,小于$\frac{0.0275mol/L}{0.04mol/L}$×100%=68.75%,NO含量减小;
故答案为:正反应方向,<,减小;
(4)若在反应开始时加入催化剂(其他条件都不变),反应速率加快,相同时间内NO2浓度变化量增大,到达平衡时间缩短,但不影响平衡移动,达到平衡是NO2浓度约为0.0125mol/L,据此用虚线画出加催化剂后的反应进程曲线为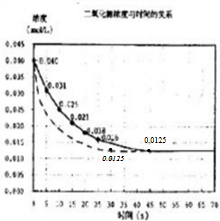 ,
,
故答案为: ;
;
点评 本题考查化学平衡速率的有关计算、平衡常数、影响反应速率与平衡移动的因素等,题目难度中等,注意基础知识的理解掌握.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | 汽车制造商:车的外形变得美观,能够提高销量;易于加工,降低成本 | |
| B. | 车主:车的重量减轻,油耗降低;汽车价格便宜 | |
| C. | 意外被保险杠撞到的行人:具有缓冲作用,减轻伤害 | |
| D. | 旁观者:用塑料作保险杠不安全 |
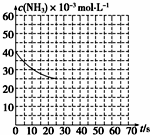 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: N2(g)+3H2( g)═2NH3(g)△H=-92.4 kJ•mol-1 .
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0
通过下列哪种措施可提高CO的吸收效率A(填字母)
A.高压 B.高温 C.把[Cu(NH3)3]CH3COO•CO分离出去 D.增大CO浓度
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
①你认为该溶液呈碱(填“酸”、“中”或“碱”性),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
| A. | $\overline{v}$(O2)=0.3 mol•L-1•s-1 | B. | $\overline{v}$(NO)=0.24mol•L-1•s-1 | ||
| C. | $\overline{v}$(NH3)=0.12 mol•L-1•s-1 | D. | $\overline{v}$(H2O)=0.36mol•L-1•min-1 |
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | ||
| ②Na2SO4 (MgSO4) | ||
| ③NaCl (Na2CO3) |
| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
 其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.
其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.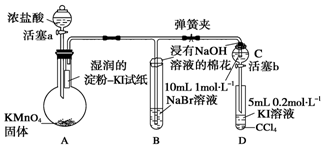
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.