题目内容
18.在5升的密闭容器中加入一定物质的量的NH3和O2,进行4NH3+5O2?4NO+6H2O反应,30秒后,测的NO 的物质的量为0.3mol,此反应的平均反应速率用NO来表示为多少?若用O2的浓度变化来表示此反应速率是多少?各物质的化学反应速率之比是多少?分析 根据v=$\frac{\frac{△n}{V}}{△t}$计算v(NO),利用各种物质的反应速率之比等于其计量数之比计算其它气体表示的反应速率.
解答 解:在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L.s),
v(O2)=$\frac{5}{4}$v(NO)=0.002mol/(L.s)×$\frac{5}{4}$=0.0025mol/(L.s),
4NH3+5O2?4NO+6H2O反应胜率之比等于化学方程式计量数之比v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,
答:此反应的平均反应速率用NO来表示为0.002mol/(L.s),若用O2的浓度变化来表示此反应速率是0.0025mol/(L.s),各物质的化学反应速率之比是v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6.
点评 本题考查化学反应速率的计算,明确反应速率之比等于化学计量数之比即可解答,题目难度不大.

练习册系列答案
相关题目
8.欲将CaCl2溶液中含有的盐酸除掉,应采用的最好方法是( )
| A. | 加生石灰,过滤 | B. | 加适量的AgNO3溶液 | ||
| C. | 加过量的Na2CO3溶液 | D. | 加CaCO3粉末,过滤 |
6.将19.2g Cu溶于100mL浓度均为1mol•L-1的HNO3和H2SO4的混合溶液中,若产生的气体为NO,则产生的NO在标准状况下的体积为( )
| A. | 2.24 L | B. | 1.68 L | C. | 3.36 L | D. | 1.12 L |
13.下列关于蛋白质的叙述中不正确的是( )
| A. | 重金属盐类能使蛋自质凝结.所以误食重金属盐类能使人中毒 | |
| B. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| C. | 人工合成具有生命活力的蛋白质--结晶牛胰岛素是我国科学家在1965年首次合成 | |
| D. | 浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应 |
10.现在许多汽车的保险杠是用塑料制造的,取代以前的钢制保险杠.下列不同的人士站在不同的角度对这种改变的看法,不正确的是( )
| A. | 汽车制造商:车的外形变得美观,能够提高销量;易于加工,降低成本 | |
| B. | 车主:车的重量减轻,油耗降低;汽车价格便宜 | |
| C. | 意外被保险杠撞到的行人:具有缓冲作用,减轻伤害 | |
| D. | 旁观者:用塑料作保险杠不安全 |
4. 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.
(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: N2(g)+3H2( g)═2NH3(g)△H=-92.4 kJ•mol-1 .
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0
通过下列哪种措施可提高CO的吸收效率A(填字母)
A.高压 B.高温 C.把[Cu(NH3)3]CH3COO•CO分离出去 D.增大CO浓度
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
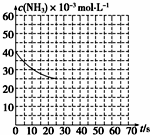
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①你认为该溶液呈碱(填“酸”、“中”或“碱”性),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: N2(g)+3H2( g)═2NH3(g)△H=-92.4 kJ•mol-1 .
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0
通过下列哪种措施可提高CO的吸收效率A(填字母)
A.高压 B.高温 C.把[Cu(NH3)3]CH3COO•CO分离出去 D.增大CO浓度
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
①你认为该溶液呈碱(填“酸”、“中”或“碱”性),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
5.下列解释事实的方程式正确的是( )
| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
 已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题:
已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题: