题目内容
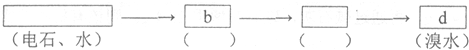
8.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去杂质,再与溴水反应.
请回答下列问题:
(1)写出甲同学实验中制乙炔及乙炔使溴水褪色的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2.
(2)甲同学设计的实验不能(填能或不能)验证乙炔与溴发生加成反应,其理由是AC(多选扣分).
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔
D.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是H2S,它与溴水反应的化学方程式是Br2+H2S═S↓+2HBr,在验证过程中必须全部除去.
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.可选用的装置:
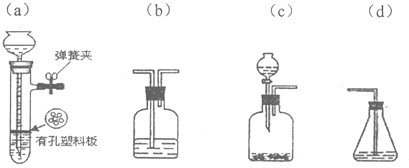
所选装置、连接顺序及装置内所放的化学药品:
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
分析 (1)碳化钙能与水反应生成乙炔,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(5)根据取代反应的特征是:有去有回来回答.
解答 解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,
故答案为:不能;AC;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,
故答案为: ;(CuSO4溶液);
;(CuSO4溶液); ;(CuSO4溶液);
;(CuSO4溶液);
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
相关题目
1.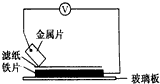 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
已知构成原电池两电极的金属活动性相差越大,电压表读数越大.请根据以上实验记录完成下列填空:
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
2.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
20.CuSO4是一种重要的化工原料,有关制备及性质如下所示.下列说法错误的是( )

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
18.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 可用漂白粉和漂白液对地震后的受灾地区进行杀菌消毒 |
 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。


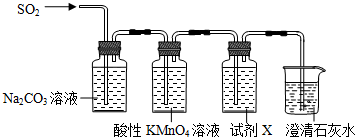
 (一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.