题目内容
17. (一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5kJ•mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.30kJ•mol-1.
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是用沙土扑灭.
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染.处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑.
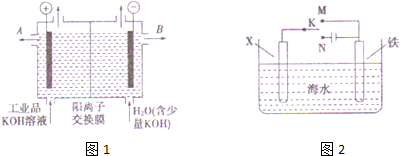
(4)电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图1所示,电源正极为a(填“a”或“b”);若总反应为4NO3-+4H+═5O2↑+2N2↑+2H2O,当阴极产生1mol气体时,则阴极溶液的质量减轻18g.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(5)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物K2FeO4水溶液稳定性的是B
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
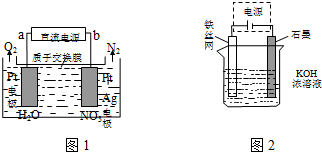
(6)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如上图2所示.电解过程中阳极的电极反应式为Fe+8OH--6e-=FeO42-+4H2O.
分析 (1)盖斯定律的内容为:化学反应的反应热值与反应的始态和终态有关,而与反应进行的途径无关;根据盖斯定律,用第一个热化学方程式减去第二个热化学方程式可得焦炭与水蒸气反应的热化学方程式;
(2)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,据此回答;
(3)NaClO在碱性条件下跟NaCN反应生成氮气;双氧水将废水中的CN-氧化成无毒的物质;
(4)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则b为负极,a为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒计算;
(5)K2FeO4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;在常温和干燥的条件下,化合物K2FeO4可以稳定的存在,但它在水溶液中不稳定等分析如何提高K2FeO4水溶液稳定性;
(6)电解时阳极Fe失电子发生氧化反应.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.81kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.30kJ•mol-1;
(2)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,件数钠着火,可以用沙土扑灭,故答案为:用沙土扑灭;
(3)NaClO在碱性条件下跟NaCN反应生成氮气,反应的离子反应方程式:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;双氧水将废水中的CN-氧化成无毒的物质,得到CN-被氧化后的产物为HCO3-(或CO32-)、N2,故答案为:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;
(4)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则b为负极,a为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,总反应为4NO3-+4H+═5O2↑+2N2↑+2H2O,当阴极产生1mol气体时,则溶液的质量减轻相当于是1mol氧原子,质量是18g,故答案为:a;18;
(5)A.亚硫酸钠具有还原性,会被高铁酸钾氧化,故A错误;
B.高铁酸钾在碱性条件下生成,故B正确;
C.高铁酸钾在水溶液中不稳定,与酸反应,故C错误;
D.在常温和干燥的条件下,高铁酸钾可以稳定的存在,但它在水溶液中不稳定,故D错误;
故答案为:B;
(6)Na2FeO4能消毒、净水的原因高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用,电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题反应热和反应方程式书写电解池及难溶电解质的相关知识,注意知识的归纳和梳理是关键,难度中等.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案②K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2↑+7H2O
③MnO2+4HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(大于6mol•L-1)反应,MnO2需和浓盐酸反应(大于8mol•L-1)反应.根据以上信息,下列叙述不正确的是( )
| A. | 上述各反应均既属于氧化还原反应,有属于离子反应 | |
| B. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 | |
| C. | 盐酸的浓度越大,Cl-的还原性越强 | |
| D. | 每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值) |
| A. | Mg2+、Fe3+、Cl-、H+ | B. | Fe2+、SO42-、CO32-、NO3- | ||
| C. | Ba2+、NO3-、Cl-、Na+ | D. | K+、NH4+、SO42-、HCO3- |
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 氯化钙溶液 | D. | 漂白粉溶液 |
| A. | 标准状况下,33.6 L H2O含有的H2O分子数为1.5 NA | |
| B. | 常温常压下,32g O2和28 g N2所含分子个数比为1:1 | |
| C. | 0.5 mol/L AlCl3溶液中含有的Cl-数为1.5 NA | |
| D. | 1 mol Na2O2与足量CO2完全反应转移的电子数目为2 NA |
 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答: