题目内容
13.某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:(1)用图装置制取并收集SO2以验证其氧化性

①实验时为控制SO2产生的快慢,应采取的措施是控制滴浓硫酸的速度.
②烧杯中NaOH溶液的作用是吸收SO2气体,防止污染环境.
③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,则反应后生成的含硫物质可能是S、MgS、MgS和S、S和MgSO3(填化学式).
④若将集气瓶换成盛有Na2S溶液的广口瓶,发现通气一段时间后产生大量淡黄色浑浊,经测定,产物中还有一种相对分子质量为104的酸式盐.则该反应的离子方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-.
(2)用如图装置验证H2SO3比H2CO3酸性强
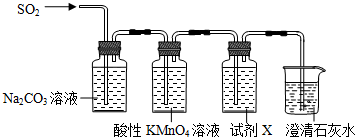
⑤试剂X是品红溶液,其作用是检验SO2是否除尽.
⑥当观察到品红溶液不褪色,澄清石灰水变浑浊,即证明H2SO3比H2CO3酸性强.
分析 (1)根据装置图可知,实验中用亚硫酸钠与浓硫酸反应制二氧化硫,用向上排空气法收集,用氢氧化钠溶液吸收二氧化硫尾气;
①实验时为控制SO2产生的快慢,可以控制滴浓硫酸的速度;
②二氧化硫有毒,会污染空气,所以要进行尾气吸收;
③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,发生氧化还原反应,根据化合价升降推测可能的物质;
④将二氧化硫通入有Na2S溶液的广口瓶,发现通气一段时间后产生大量淡黄色浑浊,应为硫,同时生成相对分子质量为104的酸式盐应为NaHSO3,根据电荷守恒和元素守恒书写离子方程式;
(2)验证H2SO3比H2CO3酸性强,可以用亚酸与碳酸盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强,据此答题;
解答 解:(1)根据装置图可知,实验中用亚硫酸钠与浓硫酸反应制二氧化硫,用向上排空气法收集,用氢氧化钠溶液吸收二氧化硫尾气,
①实验时为控制SO2产生的快慢,可以控制滴浓硫酸的速度,
故答案为:控制滴浓硫酸的速度;
②二氧化硫有毒,会污染空气,所以要进行尾气吸收,所以烧杯中NaOH溶液的作用是吸收SO2气体,防止污染环境,
故答案为:吸收SO2气体,防止污染环境;
③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,发生氧化还原反应,硫的化合价降低,根据化合价升降推测可知,反应后生成的含硫物质可能是S、MgS、MgS和S、S和MgSO3,
故答案为:S、MgS、MgS和S、S和MgSO3;
④将二氧化硫通入有Na2S溶液的广口瓶,发现通气一段时间后产生大量淡黄色浑浊,应为硫,同时生成相对分子质量为104的酸式盐应为NaHSO3,反应的离子方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-,
故答案为:2S2-+5SO2+2H2O=3S↓+4HSO3-;
(2)验证H2SO3比H2CO3酸性强,可以用亚酸与碳酸盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强,
⑤根据上面的分析可知,试剂X是 品红溶液,其作用是 检验SO2是否除尽,
故答案为:品红溶液;检验SO2是否除尽;
⑥当观察到 品红溶液不褪色,澄清石灰水变浑浊,即证明H2SO3比H2CO3酸性强,
故答案为:品红溶液不褪色,澄清石灰水变浑浊.
点评 本题属于探究实验,考查了二氧化硫的性质,涉及实验基本操作、氧化还原反应原理的应用,方程式的书写等,考查知识点较多,难度中等,注意元素化合知识与化学实验的综合应用.

| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=$\frac{c{a}^{2}}{1-a}$.
②K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2↑+7H2O
③MnO2+4HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(大于6mol•L-1)反应,MnO2需和浓盐酸反应(大于8mol•L-1)反应.根据以上信息,下列叙述不正确的是( )
| A. | 上述各反应均既属于氧化还原反应,有属于离子反应 | |
| B. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 | |
| C. | 盐酸的浓度越大,Cl-的还原性越强 | |
| D. | 每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值) |
| A. | Mg2+、Fe3+、Cl-、H+ | B. | Fe2+、SO42-、CO32-、NO3- | ||
| C. | Ba2+、NO3-、Cl-、Na+ | D. | K+、NH4+、SO42-、HCO3- |
| A. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH-═AlO2-+2H2O |

 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: