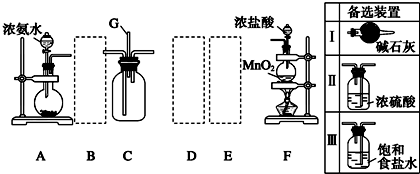
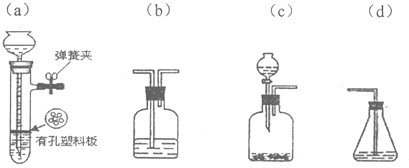
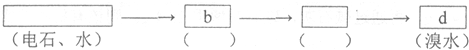
题目内容
2.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
分析 保持温度不变,将体积压缩为原来的$\frac{1}{2}$,如平衡不移动,A气体的浓度为1mol/L,实际上A的浓度变为0.9mol/L,说明平衡向正方向移动,据此结合选项解答.
解答 解:保持温度不变,将体积压缩为原来的$\frac{1}{2}$,如平衡不移动,A气体的浓度为1mol/L,实际上A的浓度变为0.8mol/L,说明平衡向正方向移动,
A、压强增大反应速率增大,正逆反应速率都增大,故A错误.
B、体积减小即压强增大,平衡向正方向移动,故B正确;
C、平衡向正方向移动,B的转化率增大,故C正确;
D、体积减小,压强增大,平衡向正方向移动,所以正方向是气体系数和减小的方向,a+b>c+d,故D错误;
故选BC.
点评 本题考查学生影响化学平衡移动的因素等方面的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
9.下列物质不能使有色布条褪色的是( )
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 氯化钙溶液 | D. | 漂白粉溶液 |
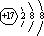 .乙的单质的电子式为
.乙的单质的电子式为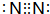 .
. 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答: