题目内容
12.合金是生活中常用的材料,请回答下列问题:(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为生铁,比较稳定、不易生锈,有较强的抗腐蚀能力,其合金元素主要是铁、镍和铬.
(2)青铜主要合金元素为铜锡,黄铜的主要合金元素为铜锌.
分析 (1)生铁的含碳量为2%-4.3%;不锈钢中添加的主要合金元素是镍和铬;
(2)青铜是铜锡合金,黄铜是铜锌合金.
解答 解:(1)含碳量在2%~4.3%的称为生铁;不锈钢中添加的主要合金元素是铁、镍和铬,故答案为:生铁;铁、镍和铬;
(2)青铜是铜锡合金,黄铜是铜锌合金,故答案为:铜锡;铜锌.
点评 本题考查生活中常见合金的组成,难度不大,了解不锈钢的组成成分是正确解答本题的关键.

练习册系列答案
相关题目
2.下列各组物质的稀溶液,不用其他的试剂只根据相互滴加的方法,不能鉴别的是( )
| A. | AlCl3 和NaOH | B. | NaAlO2和HCl | C. | Na2CO3和HCl | D. | NaHCO3和Ca(OH)2 |
7.可逆反应AsO43-+2H++2I-?AsO33-+I2+H2O可设计成原电池,下列说法不正确的是( )
| A. | 负极的电极反应式为2I--2e-═I2 | |
| B. | 正极的电极反应式为AsO43-+2H++2e-?AsO33-+H2O | |
| C. | 利用酸度计(ph计)测定溶液的pH,若溶液的pH不再发生变化,应达到平衡 | |
| D. | 利用该反应设计原电池,利用毫安表测定电池的电流强度,当电池达到最大时,反应达到平衡 |
17.关于化学能与热能的叙述,正确的是( )
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
4.合理施肥、养护管理是城市绿化建设的一个重要方面.在下列氮肥中.含氮量最高的是( )
| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
11.下列有关说法正确的是( )
| A. | 一定条件下反应N2+3H2$?_{加热}^{催化剂}$2NH3,达到平衡时,3v正(H2)=2v正(NH3) | |
| B. | 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 | |
| C. | 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 | |
| D. | 常温下,向浓度为0.1mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
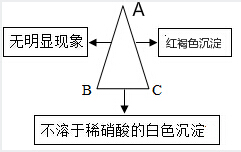 现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:
现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题: