题目内容
4.合理施肥、养护管理是城市绿化建设的一个重要方面.在下列氮肥中.含氮量最高的是( )| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
分析 氮肥中的含氮量=$\frac{所有N原子的相对原子质量}{物质的相对分子质量}$×100%,据此计算含氮肥料中的含氮量.
解答 解:A、C0(NH2)2的含氮量=$\frac{28}{60}$×100%=46.7%;
B、NH4NO3的含氮量=$\frac{28}{80}$×100%=35%;
C、NH4HCO3的含氮量=$\frac{14}{79}$×100%=17.7%;
D、(NH4)2SO4的含氮量=$\frac{28}{128}$×100%=21.9%.
含氮量最高的是C0(NH2)2.
故选A.
点评 本题考查学生元素质量分数的计算,注意氮肥中的含氮量=$\frac{所有N原子的相对原子质量}{物质的相对分子质量}$×100%计算公式的应用,难度中等.

练习册系列答案
相关题目
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
19.某工厂用如图所示的流程图除去工业废气中含有的H2S,下列说法中正确的是( )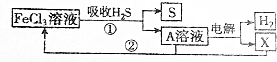

| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
9.有一粗铝,含铁和硅两种杂质,取等量的两份样品,分别投入100mL稀盐酸和0.2mol•L-1的氢氧化钠溶液中,恰好完全反应且都放出标准状况下1.12LH2,下列说法正确的是( )
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |
5.一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是CE(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
2.下列说法不正确的是( )
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |