题目内容
10.实验室要配制480mL 0.2mol/L NaCl溶液,实验室只有含有少量硫酸钠的氯化钠固体,设计如下方案,请回答下列问题:Ⅰ粗盐提纯

(1)固体A的化学式为BaSO4BaCO3;
(2)试剂2的名称为碳酸钠,判断试剂2是否过量的方法取上层清液滴加BaCl2,有白色沉淀产生则未过量,反之过量,操作3的名称蒸发结晶.
(3)加入试剂1,3发生反应的离子方程式分别为:Ba2++SO42-=BaSO4
Ⅱ配置溶液
(1)配制过程中不需要使用的化学仪器有C(填选项的字母).
A.烧杯 B.500mL容量瓶 C.漏斗 D.胶头滴管
(2)用托盘天平称取氯化钠,其质量为58.5g.
(3)下列主要操作步骤的正确顺序是①③⑤②④(填序号).
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(4)如果实验过程中缺少步骤⑤,会使配制出的NaCl溶液浓度偏低(填“偏高”或“偏低”或“不变”).
分析 Ⅰ粗盐中含与硫酸钠,除去硫酸根离子应选择氯化钡溶液,然后在用碳酸钠溶液除去过量的氯化钡,过滤得到的溶液中含有碳酸钠和氯化钠,加入足量的盐酸除去过量的碳酸根离子,经过蒸发结晶得到纯净的氯化钠;检验试剂2碳酸钠是否过量只需要检验溶液中是否含有碳酸根离子存在即可;从氯化钠溶液中得到氯化钠固体操作的为蒸发结晶;
Ⅱ(1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)配制480mL 0.2mol/L NaCl溶液,应选择500mL容量瓶,依据m=CVM计算需要溶质的质量;
(3)依据配制一定物质的量浓度溶液的一般步骤排序;
(4)实验过程中缺少步骤⑤,导致溶质的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:Ⅰ粗盐中含与硫酸钠,除去硫酸根离子应选择试剂1氯化钡溶液,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,然后在用试剂2碳酸钠溶液除去过量的氯化钡,过滤得到的溶液中含有碳酸钠和氯化钠,加入足量的试剂3盐酸,盐酸与碳酸钠反应生成氯化钠和二氧化碳和水,可以除去过量的碳酸根离子,最后经过蒸发结晶得到纯净的氯化钠;
(1)所以固体A的化学式为:BaSO4 BaCO3;
故答案为:BaSO4 BaCO3;
(2)试剂2的名称为碳酸钠;检验试剂2碳酸钠是否过量只需要检验溶液中是否含有碳酸根离子存在即可,操作为:取上层清液滴加BaCl2,有白色沉淀产生则未过量,反之过量;
从氯化钠溶液中得到氯化钠固体操作的为蒸发结晶;
故答案为:碳酸钠; 取上层清液滴加BaCl2,有白色沉淀产生则未过量,反之过量;蒸发结晶;
(3)氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,离子方程式:Ba2++SO42-=BaSO4;
盐酸与碳酸钠反应生成氯化钠和二氧化碳和水,离子方程式:2H++CO32-=H2O+CO2↑;
故答案为:Ba2++SO42-=BaSO4;2H++CO32-=H2O+CO2↑;
Ⅱ(1)配制一定物质的量浓度溶液的一般步骤:算、称量、溶解、移液、洗涤、定容等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管;所以用不到的仪器:漏斗;
故选:C;
(2)配制480mL 0.2mol/L NaCl溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.2mol/L×0.5L×58.5g/mol=58.5g;
故答案为:58.5;
(3)配制一定物质的量浓度溶液的一般步骤:算、称量、溶解、移液、洗涤、定容等,所以正确的顺序为:①③⑤②④;
故答案为:①③⑤②④;
(4)实验过程中缺少步骤⑤,导致溶质的物质的量偏小,依据C=$\frac{n}{V}$可知溶液浓度偏低;
故答案为:偏低.
点评 本题考查了粗盐的提纯、一定物质的量浓度溶液的配制,熟悉物质除杂原则及发生反应、溶液配制原理和操作步骤是解题关键,题目难度不大.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案| A. | 按系统命名法,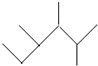 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
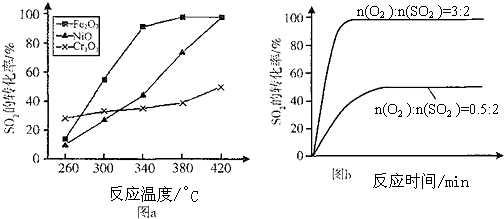
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.