题目内容
2.下列各组物质的稀溶液,不用其他的试剂只根据相互滴加的方法,不能鉴别的是( )| A. | AlCl3 和NaOH | B. | NaAlO2和HCl | C. | Na2CO3和HCl | D. | NaHCO3和Ca(OH)2 |
分析 不加其他试剂进行鉴别,则首先需要考虑物质的水溶液的颜色,然后物质间相互滴加的顺序不同,产生不同现象进行鉴别,以此解答.
解答 解:A.NaOH溶液和AlCl3溶液滴加顺序不同,现象不同:将NaOH溶液滴加到AlCl3 溶液中,先生成沉淀,当NaOH过量时,沉淀溶解,可鉴别,故A不选;
B.NaAlO2和稀盐酸,当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,故B不选;
C.Na2CO3 和HCl溶液滴加顺序不同,现象不同:将Na2CO3 滴加到HCl溶液中马上有气体产生,但将HCl滴加到Na2CO3 溶液中,先没有气体生成,当滴加到一定程度时,才有气体生成,可鉴别,故C不选;
D.Ca(OH)2和NaHCO3,无论二者谁过量,都会生成碳酸钙沉淀,所以现象相同,不能鉴别,故D选.
故选D.
点评 本题考查了常见物质的鉴别,把握物质的颜色及相互滴加时发生的化学反应为解答的关键,注意物质的性质差异来鉴别物质,题目难度不大.

练习册系列答案
相关题目
12.已知某药物具有抗痉挛作用,制备该药物其中一步反应为:
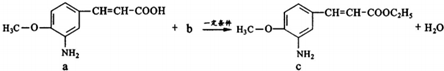
下列说法不正确的是( )
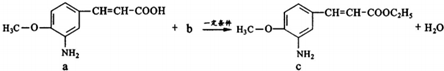
下列说法不正确的是( )
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
13.已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时硝酸的还原产物可能是( )
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |
10.下列说法正确的是( )
| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
7.高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平),下列有关说法不正确的是( )
| A. | 由上述反应可知,Fe(OH)3的氧化性强于FeO42- | |
| B. | 高铁酸钾中铁显+6价 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
11.下列说法正确的是( )
| A. | 按系统命名法,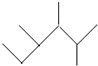 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
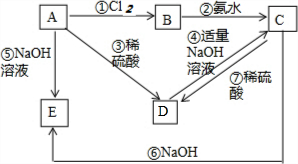 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)