题目内容
20.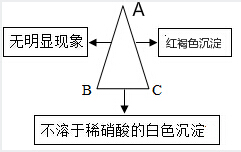 现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:
现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:(1)A的化学式是FeCl3.
(2)B与C反应的化学方程式为Ba(OH)2+Na2SO4=BaSO4↓+2NaOH.
(3)将镁粉逐渐投入A的饱和溶液中.开始时看到溶液逐渐变成红褐色,并产生气泡,但无沉淀生成;后来,溶液出现浑浊,出现少量红褐色的沉淀,同时有少量能被磁铁吸引的黑色沉淀物质生成.经分析,该黑色物质是一种元素.则气泡的成分是氢气,黑色物质是铁;开始时溶液变成红褐色的原因是铁离子水解生成红褐的氢氧化铁.
分析 A、B、C三种物质,A是一种氯化物,C是一种碱,A与C反应生成一红褐色沉淀,则A为FeCl3,B是一种钠盐,B和C反应生成不溶于硝酸的白色沉淀,则C为Ba(OH)2,B为Na2SO4,硫酸钠与氯化铁无现象,符合各物质转化关系,氯化铁溶液中铁离子水解,使溶液呈酸性,所以将镁粉逐渐投入氯化铁的饱和溶液中,镁与氢离子反应,促进铁离子的水解,生成红褐色氢氧化铁和氢气,同时镁是活泼金属,能还原铁离子生成铁单质,据此答题;
解答 解:A、B、C三种物质,A是一种氯化物,C是一种碱,A与C反应生成一红褐色沉淀,则A为FeCl3,B是一种钠盐,B和C反应生成不溶于硝酸的白色沉淀,则C为Ba(OH)2,B为Na2SO4,硫酸钠与氯化铁无现象,符合各物质转化关系,
(1)A的化学式是FeCl3,
故答案为:FeCl3;
(2)B与C反应的化学方程式为 Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,
故答案为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;
(3)氯化铁溶液中铁离子水解,使溶液呈酸性,所以将镁粉逐渐投入氯化铁的饱和溶液中,镁与氢离子反应,促进铁离子的水解,开始时看到溶液逐渐变成红褐色,并产生气泡,但无沉淀生成,后来,溶液出现浑浊,出现少量红褐色的沉淀,同时镁是活泼金属,能还原铁离子生成铁单质,所以气泡的成分是氢气,黑色物质是铁,开始时溶液变成红褐色的原因是铁离子水解生成红褐的氢氧化铁,
故答案为:氢气;铁;铁离子水解生成红褐的氢氧化铁.
点评 本题考查各物质相互转化及性质,难度中等,解题关键是根据物质的颜色确定A及铁离子的水解,答题是注意基础知识的灵活运用.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
11.下列说法正确的是( )
| A. | 按系统命名法,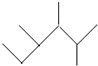 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
8.如图有关实验操作不能达到相应目的是( )
| A. | 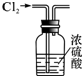 干燥Cl2 | B. |  分离汽油与食盐溶液 | ||
| C. | 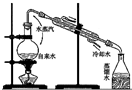 实验室制取少量蒸馏水 | D. | 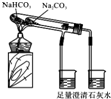 比较Na2CO3与NaHCO3的稳定性 |
5.下列实验操作正确的是( )
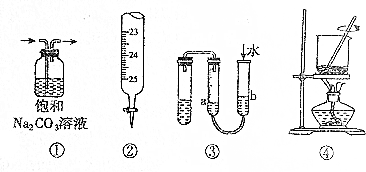

| A. | ①用于除去CO2中的SO2 | B. | ②用于量取20.00mL Na0H溶液 | ||
| C. | ③用于判断装置的气密性 | D. | ④用于将海带燃烧成灰 |
9.有一粗铝,含铁和硅两种杂质,取等量的两份样品,分别投入100mL稀盐酸和0.2mol•L-1的氢氧化钠溶液中,恰好完全反应且都放出标准状况下1.12LH2,下列说法正确的是( )
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |