题目内容
7.可逆反应AsO43-+2H++2I-?AsO33-+I2+H2O可设计成原电池,下列说法不正确的是( )| A. | 负极的电极反应式为2I--2e-═I2 | |
| B. | 正极的电极反应式为AsO43-+2H++2e-?AsO33-+H2O | |
| C. | 利用酸度计(ph计)测定溶液的pH,若溶液的pH不再发生变化,应达到平衡 | |
| D. | 利用该反应设计原电池,利用毫安表测定电池的电流强度,当电池达到最大时,反应达到平衡 |
分析 反应AsO43-+2I-+2H+?AsO33-+I2+H2O 设计成原电池,As元素的化合价降低,I元素的化合价升高,则负极发生的氧化反应2I--2e-═I2,正极发生的还原反应AsO43-+2H++2e-?AsO33-+H2O,以此来解答.
解答 解:A、反应AsO43-+2I-+2H+?AsO33-+I2+H2O 设计成原电池,As元素的化合价降低,I元素的化合价升高,则负极发生的氧化反应2I--2e-═I2,故A正确;
B、应AsO43-+2I-+2H+?AsO33-+I2+H2O 设计成原电池,As元素的化合价降低,I元素的化合价升高,正极发生的还原反应AsO43-+2H++2e-?AsO33-+H2O,故B正确;
C、利用酸度计(ph计)测定溶液的pH,若溶液的pH不再发生变化,即氢离子浓度不再发生变化,此事反应达到平衡,故C正确;
D、利用该反应设计原电池,利用毫安表测定电池的电流强度,电流示数是零时,反应达到平衡,故D错误.
故选D.
点评 本题考查原电池,注意利用氧化还原反应来分析发生的电极反应,选项D为解答的难点,题目难度中等.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 室温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 室温下,1L pH=12的Ba(OH)2溶液中OH-数目为0.2NA | |
| D. | 室温下,1L pH=1的盐酸中,由水电离的H+数目为10-13NA |
19.某工厂用如图所示的流程图除去工业废气中含有的H2S,下列说法中正确的是( )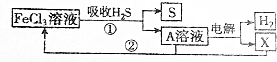

| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
5.一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是CE(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
6.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
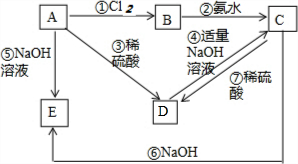 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)