题目内容
17.关于化学能与热能的叙述,正确的是( )| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
分析 A、根据中和热的概念来分析;
B、反应中的能量变化与反应物的量成正比;
C、很多物理过程也伴随着能量的变化;
D、化学键的断裂要吸收衡量,化学键的形成要放出能量.
解答 解:A、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,故A错误;
B、反应中的能量变化与反应物的量成正比,即与物质的质量成正比,故B错误;
C、很多物理过程也伴随着能量的变化,故有能量变化的过程不一定是化学变化,但化学变化一定有能量变化,故C错误;
D、化学键的断裂要吸收衡量,化学键的形成要放出能量,故化学反应中的能量变化,是由化学键的断裂和形成引起的,故D正确.
故选D.
点评 本题考查了中和热的概念、化学反应与能量变化的关系以及化学反应吸放热的原因,难度不大,属于基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平),下列有关说法不正确的是( )
| A. | 由上述反应可知,Fe(OH)3的氧化性强于FeO42- | |
| B. | 高铁酸钾中铁显+6价 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
8.如图有关实验操作不能达到相应目的是( )
| A. | 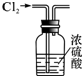 干燥Cl2 | B. | 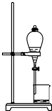 分离汽油与食盐溶液 | ||
| C. | 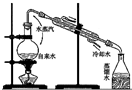 实验室制取少量蒸馏水 | D. | 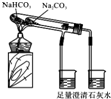 比较Na2CO3与NaHCO3的稳定性 |
5.下列实验操作正确的是( )
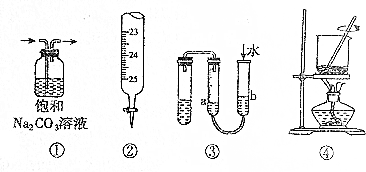

| A. | ①用于除去CO2中的SO2 | B. | ②用于量取20.00mL Na0H溶液 | ||
| C. | ③用于判断装置的气密性 | D. | ④用于将海带燃烧成灰 |
2.下列说法正确的是( )
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |
9.有一粗铝,含铁和硅两种杂质,取等量的两份样品,分别投入100mL稀盐酸和0.2mol•L-1的氢氧化钠溶液中,恰好完全反应且都放出标准状况下1.12LH2,下列说法正确的是( )
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |
15.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
回答下列问题:
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.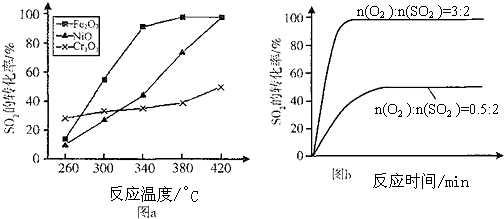
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.
