题目内容
下列关于2mol?L-1 NaOH 溶液的说法中,不正确的是( )
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、依据n=
计算物质的量,溶于1L溶液中溶于体积大于1L;
B、浓度含义是1L溶液中含有2mol氢氧化钠;
C、体积不知离子数不能计算;
D、离子浓度=溶质浓度×化学式中离子数.
| m |
| M |
B、浓度含义是1L溶液中含有2mol氢氧化钠;
C、体积不知离子数不能计算;
D、离子浓度=溶质浓度×化学式中离子数.
解答:
解:A、依据n=
计算物质的量,溶于1L溶液中溶于体积大于1L,所得溶液中NaOH的物质的量浓度小于2 mol?L-1,故A错误;
B、2mol?L-1 NaOH 溶液,浓度含义是1L溶液中含有2mol氢氧化钠,故B正确;
C、溶液体积不知,离子数不能计算,故C错误;
D、离子浓度=溶质浓度×化学式中离子数=2mol?L-1×1=2mol?L-1,故D正确;
故选BD.
| m |
| M |
B、2mol?L-1 NaOH 溶液,浓度含义是1L溶液中含有2mol氢氧化钠,故B正确;
C、溶液体积不知,离子数不能计算,故C错误;
D、离子浓度=溶质浓度×化学式中离子数=2mol?L-1×1=2mol?L-1,故D正确;
故选BD.
点评:本题考查了物质的量浓度概念分析应用,注意溶液中体积的理解应用,掌握概念实质是关键.

练习册系列答案
相关题目
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A、原子半径:Z>Y>X |
| B、R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
| C、X和Z形成的化合物能溶于NaOH溶液 |
| D、Y和W形成的化合物中,阴阳离子的个数可能比为1:1 |
已知H2A为弱酸,下列说法错误的是( )
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
下列气体中所含分子数目最多的是( )
| A、1g H2 |
| B、10g O2 |
| C、30gCl2 |
| D、17g NH3 |
下列叙述正确的是( )
| A、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| D、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
常温下,2L物质的量浓度为0.5mol?L-1 KOH溶液含有( )
| A、1 mol的K+ |
| B、0.5 mol的H+ |
| C、1.0 mol的H+ |
| D、1.0 mol的OH- |
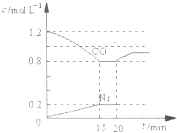 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);