题目内容
4.T1 K时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是( )| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
分析 CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 3 0 0
转化 1.2 1.2 1.2 1.2
t1时 0.8 1.8 1.2 1.2
t2>t1,n(H2O)不变,可知,t1时达到平衡,
A.结合v=$\frac{△c}{△t}$计算;
B.t1时向容器中充入3.00 mol N2,因容器体积不变,平衡不移动;
C.t2 min时向容器中再通入1.00 mol CO,平衡正向移动,促进H2O(g)的转化;
D.K=$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×0.9mol/L}$=1,温度升至T2 K,上述反应的平衡常数为0.70,可知升高温度,平衡逆向移动.
解答 解:CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 3 0 0
转化 1.2 1.2 1.2 1.2
t1时 0.8 1.8 1.2 1.2
t2>t1,n(H2O)不变,可知,t1时达到平衡,
A.用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{\frac{1.2mol}{2L}}{{t}_{1}min}$=$\frac{0.60}{t_1}$mol•L-1•min-1,故A正确;
B.t1时向容器中充入3.00 mol N2,因容器体积不变,平衡不移动,则n(CO2)=1.20 mol,故B正确;
C.t2 min时向容器中再通入1.00 mol CO,平衡正向移动,促进H2O(g)的转化,而CO的转化率将减小,故C错误;
D.K=$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×0.9mol/L}$=1,温度升至T2 K,上述反应的平衡常数为0.70,可知升高温度,平衡逆向移动,则反应的△H<0,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K与速率的计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意选项BC为解答的易错点,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)═c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| A. | 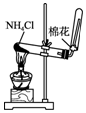 制备氨气 | B. | 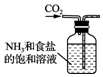 制取NaHCO3 | C. | 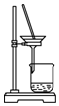 分离NaHCO3 | D. | 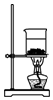 灼烧NaHCO3 |
| 物质性质 | 实际应用 | |
| A | 硅胶吸水能力强 | 食品、药品干燥剂 |
| B | 油脂在碱性条件下水解 | 制肥皂 |
| C | SiO2是酸性氧化物 | 光导纤维 |
| D | Na2O2与CO2、H2O反应 | 潜水艇中作为氧气来源 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 尿素属于铵态氮肥 | B. | 植物吸收氮肥属于氮的固定 | ||
| C. | 使用碳铵应深施盖土 | D. | 硫铵与石灰混用肥效增强 |
| A. | NaCl的电子式为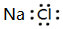 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |