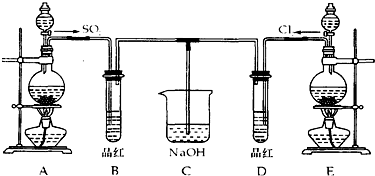
题目内容
14.在标况下,将128g铜投入到足量的浓硝酸溶液中,求生成气体的体积.分析 发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,结合电子守恒及V=nVm计算.
解答 解:n(Cu)=$\frac{128g}{64g/mol}$=2mol,由电子守恒可知,n(NO2)=$\frac{2mol×(2-0)}{(5-4)}$=4mol,其体积为4mol×22.4L/mol=89.6L,
答:生成气体的体积为89.6L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应或电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
12.某些化学知识用数轴表示能体现出形象直观、简明易记的特点.下列用数轴表示不合理 的是( )
| A. | 平衡常数与转化关系: | |
| B. | 向烧碱液中通入SO2后的产物: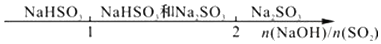 | |
| C. | 铁和稀硝酸反应: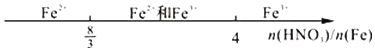 | |
| D. | 向AlCl3 溶液中滴加 NaOH 溶液,铝元素的存在形式: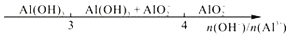 |
3.某种食用精制盐包装袋上有如表说明:
(1)写出碘酸钾与碘化钾在硫酸酸化条件下的化学方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O.
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
4.T1 K时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
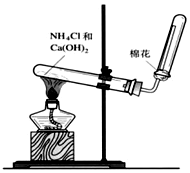 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C