题目内容
13.关于氮肥的说法正确的是( )| A. | 尿素属于铵态氮肥 | B. | 植物吸收氮肥属于氮的固定 | ||
| C. | 使用碳铵应深施盖土 | D. | 硫铵与石灰混用肥效增强 |
分析 A.尿素属于有机物,不是铵盐;
B.氮的固定是元素游离态变化为化合态;
C.碳酸氢铵受热容易分解,易溶于水;
D.硫酸铵含铵根离子,与碱性物质混合后,放出氨气,降低肥效;
解答 解:A.尿素属于有机氮肥,不属于铵态氮肥,故A错误;
B.植物吸收氮肥是吸收化合态的氮元素,不属于氮的固定,故B错误;
C.碳酸氢铵受热容易分解,易溶于水,使用碳铵应深施盖土,避免肥效损失,故C正确;
D.将硫酸铵与碱性物质熟石灰混合施用时会放出氨气而降低肥效,故D错误;
故选C.
点评 本题主要考查了农作物的生长与营养物质之间的关系问题,注意知识的积累,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
3.某种食用精制盐包装袋上有如表说明:
(1)写出碘酸钾与碘化钾在硫酸酸化条件下的化学方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O.
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
4.T1 K时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
1.下列元素非金属性最强的是( )
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 砷 |
8.某有机物结构如图所示,有关该物质的叙述正确的是( )


| A. | 易溶于水 | |
| B. | 一氯代物有5种 | |
| C. | 最多能与氢气以物质的量之比1:4加成 | |
| D. | 碱性水解的产物之一是1-丙醇 |
18.分子式为CnH2n+1Cl( n>l)的卤代烃不能发生消去反应,n的最小值是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
5.下列各项应用涉及的化学原理完全相同的是( )
| A. | 用氯化铁或液氯处理废水 | |
| B. | 用铁槽车或铝槽车运输浓硫酸 | |
| C. | 用二氧化硫或氯气漂自织物 | |
| D. | 用亚硫酸钠或氯水处理二氧化硫尾气 |
2.G是合成双酚A的原料,其结构简式如图,关于G说法不正确的是( )


| A. | 分子式为C6H10 | B. | 是乙烯的同系物 | ||
| C. | 可以发生加成反应 | D. | 难溶于水 |
8.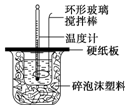 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol.根据计算结果,写出该中和反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.01kJ/mol.
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |