题目内容
14.含氯消毒液(主要成分NaClO)与含氯洁厕灵(主要成分HCl)混用可能会造成中毒,其原因是:NaClO+2HCl=Cl2↑+NaCl+H2O,下列说法中正确的是( )| A. | NaCl的电子式为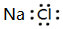 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
分析 A.NaCl只含离子键,为离子化合物;
B.NaClO含Cl-O键;
C.状况未知,Vm不确定,不能计算物质的量;
D.滴加食醋,发生强酸制取弱酸的反应生成HClO.
解答 解:A.NaCl只含离子键,为离子化合物,其电子式为 ,故A错误;
,故A错误;
B.NaClO含Cl-O共价键及离子键,故B错误;
C.状况未知,Vm不确定,不能计算物质的量,则不能确定分子数,故C错误;
D.滴加食醋,发生强酸制取弱酸的反应生成HClO,发生的离子反应为ClO-+CH3COOH=HClO+CH3COO-,故D正确;
故选D.
点评 本题考查含氯化合物,为高频考点,把握物质的构成、化学键、离子反应为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
4.T1 K时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
5.下列各项应用涉及的化学原理完全相同的是( )
| A. | 用氯化铁或液氯处理废水 | |
| B. | 用铁槽车或铝槽车运输浓硫酸 | |
| C. | 用二氧化硫或氯气漂自织物 | |
| D. | 用亚硫酸钠或氯水处理二氧化硫尾气 |
2.G是合成双酚A的原料,其结构简式如图,关于G说法不正确的是( )
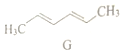

| A. | 分子式为C6H10 | B. | 是乙烯的同系物 | ||
| C. | 可以发生加成反应 | D. | 难溶于水 |
9.下列说法不正确的是( )
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 油脂发生皂化反应能生成甘油 | |
| D. | 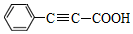 是高分子化合物 是高分子化合物 的单体 的单体 |
19.K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O?4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示.下列说法不正确的是:( )
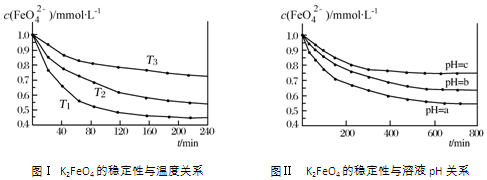

| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
8.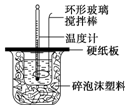 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol.根据计算结果,写出该中和反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.01kJ/mol.
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |