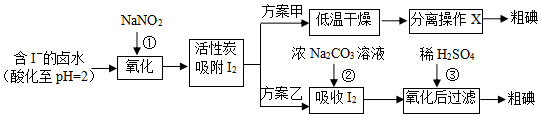
题目内容
4.金属的熔沸点与金属键强弱有关,判断下列金属熔点逐渐升高的是( )| A. | Li、Na、K | B. | Na、Mg、Al | C. | Li、Be、Mg | D. | Li、Na、Mg |
分析 金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔点越高,据此判断.
解答 解:A.Li Na K的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Li Na K的熔点依次降低,故A错误;
B.Na Mg Al的价电子数依次增多,原子半径依次减小,则金属键依次增强,所以Na Mg Al的熔点依次升高,故B正确;
C.Be Mg的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Be的熔点大于Mg,故C错误;
D.Li Na 的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Li的熔点大于Na,故D错误;
故选B.
点评 本题考查金属晶体熔点的比较,明确金属晶体熔点的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关化学用语及其叙述,不正确的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: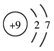 | D. | -OH的电子式: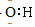 |
15.下列关于平衡常数的说法中,正确的是( )
| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
12.根据能量变化示意图得幽的结论正确的是( )


| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
9.下列离子方程式的书写不正确的是( )
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
16.下列说法正确的是( )
| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
15.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
 .
. .
.