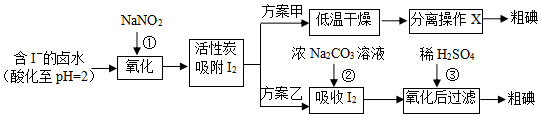
题目内容
3.下列实验室制取物质的思路既合理又符合绿色化学思想的是( )| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |
分析 A.用浓硫酸和铜反应制取硫酸铜,反应过程中会生成有毒气体二氧化硫;
B.不产生污染物,符合绿色化学;
C.Al(OH)3 属于两性氢氧化物,既能与酸反应,生成铝盐(Al3+),又能与碱反应生偏铝酸盐(AlO2-),理论上正确,实际操作无法控制硫酸的量;
D.钠和氧气在点燃的条件下,生成过氧化钠,过氧化钠和二氧化碳反应操作较为简便,但经济上不合理.
解答 解:A.铜和浓硫酸直接反应,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑生成二氧化硫,二氧化硫是一种有毒气体,不符合绿色化学思想,故A错误;
B.Cu在空气中灼烧,会与氧气生成氧化铜,氧化铜再与稀硝酸反应生成硝酸铜,从理论、经济、环保及操作等方面都很好,符合绿色化学思想,故B正确;
C.2Al+2NaOH+2H2O═2NaAlO2+3H2↑,2NaAlO2+H2SO4+2H2O═2Al(OH)3↓+Na2SO4,但硫酸一旦过量氢氧化铝会溶解,即2Al(OH)3+3H2SO4=Al2(SO4)3↓+6H2O,实际操作无法控制硫酸的量,因此该方案在操作上是不可行的,且原料的利用率低,不符合绿色化学思想,故C错误;
D.金属钠在氧气中燃烧生成过氧化钠2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,过氧化钠和二氧化碳反应2Na2O2+2CO2=2Na2CO3+O2,经济上不合理,且原料的利用率低,不符合绿色化学思想,故D错误;
故选:B.
点评 本题考查了元素化合物的性质、实验基本方案设计与评价、绿色化学等,注意实验方案设计应理论正确、操作简单可行、经济节约、绿色环保是解答的关键,题目难度不大.

练习册系列答案
相关题目
14.下列有关化学用语及其叙述,不正确的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: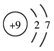 | D. | -OH的电子式: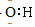 |
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol FeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
15.下列关于平衡常数的说法中,正确的是( )
| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
12.根据能量变化示意图得幽的结论正确的是( )
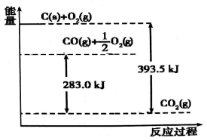

| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式: