题目内容
20.25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是( )| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
分析 A.当c1V1>c2V2时,即氢氧化钠过量时溶液呈碱性,溶液的pH>7;
B.溶液中一定满足电荷守恒,与溶液酸碱性无关;
C.pH=7时溶液呈中性,由于HA为弱酸、ROH为强碱,则酸应该稍过量;
D.若V1=V2、c1=c2,则HA与ROH的物质的量相等,根据混合液中的物料守恒判断.
解答 解:A.若pH>7时,溶液呈碱性,可能满足c1V1=c2V2或c1V1>c2V2,故A错误;
B.无论溶液pH<7还是≤7时,根据电荷守恒可知,溶液中都满足c(R+)+c(H+)=c(A-)+c(OH-),故B错误;
C.当pH=7时,溶液呈中性,由于HA为弱酸、ROH为强碱,则酸的物质的量应该稍大些,即c1V1<c2V2,若V1=V2,则一定是c1<c2,故C正确;
D.若V1=V2、c1=c2,根据n=cV可知,HA与ROH的物质的量相等,两溶液恰好反应生成NaA,根据物料守恒可得:c(A-)+c(HA)=c(R+),故D正确;
故选CD.
点评 本题考查了酸碱混合的定性判断,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理、电荷守恒及物料守恒的含义,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11. 向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
 向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )| A. | 0.25mol/L | B. | 2mol/L | C. | 1mol/L | D. | 0.5 mol/L |
11.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠溶液 | B. | 氢氧化钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
15.在日常生活中,下列做法错误的是( )
| A. | 用灼烧法鉴别毛织品和棉织品 | |
| B. | 用纯碱洗涤锅盖上的油渍 | |
| C. | 用将铁屑、溴水、苯混合制溴苯 | |
| D. | 用淀粉溶液鉴别加碘食盐和不含碘的食盐 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则NA个N2分子与足量氢气充分反应释放热量92.4kJ | |
| D. | Na2O2与CO2反应生成1 molO2时,转移的电子数为2NA |
12.关于阿佛加德罗常数NA的叙述中,正确的是( )
| A. | 10 g H218O中所含的中子数为5NA | |
| B. | 1 mol 铁单质与足量的硫单质充分反应,电子转移数目为3NA | |
| C. | 在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数小于0.2NA | |
| D. | 一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA |
9.分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是( )
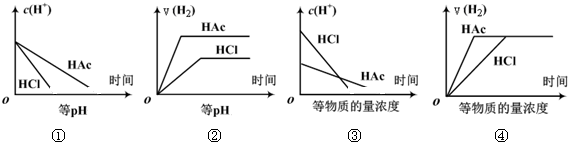

| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
10. 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |





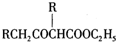 +C2H3OH,请以G为唯一有机试剂合成乙酸乙酯(CH3OCH2COOC2H3),设计合成路线(其他试剂任选),合成路线流程图示例:
+C2H3OH,请以G为唯一有机试剂合成乙酸乙酯(CH3OCH2COOC2H3),设计合成路线(其他试剂任选),合成路线流程图示例: