题目内容
9.分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是( )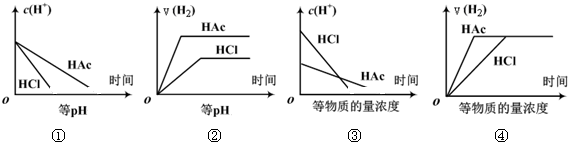
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
分析 醋酸为弱酸,不能完全电离,当pH相等时,醋酸浓度较大,溶质的物质的量较多,当等浓度时,醋酸溶液中氢离子浓度较小,以此解答该题.
解答 解:①随着反应的进行,氢离子浓度逐渐减小但是醋酸会逐渐电离出氢离子,所以醋酸中氢离子消耗的速率慢,故①正确;
②等pH时,醋酸浓度较大,加入足量锌,不仅产生的氢气的体积更大,而且反应更快,故②正确;
③等浓度的盐酸和醋酸,盐酸的pH小,和金属锌反应的速率比醋酸的快,故③正确;
④等浓度的盐酸和醋酸,和金属锌反应的速率是盐酸比醋酸的快,醋酸不可能比盐酸反应的快,故④错误.
故选C.
点评 本题考查弱电解质的电离,为高考常见题型,侧重于学生的分析能力和计算能力的考查,本题考查的侧重点为图象的分析,难度中等.

练习册系列答案
相关题目
20.目前,已经合成了LiH、NaH、CaH2、MgH2(AlH3)n等,下列说法不正确的是( )
| A. | 金属氢化物都是强还原剂 | |
| B. | 金属与H2制备金属氢化合物时,H2作还原剂 | |
| C. | 金属氢化物与水反应生成对应的碱和H2 | |
| D. | 离子半径:r(H-)>r(Li+) |
20.25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是( )
| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
17.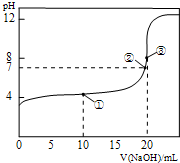 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )| A. | 点①所示溶液:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | 点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+ ) |
4.钢铁在海水中的腐蚀过程如图所示,有关说法正确的是( )
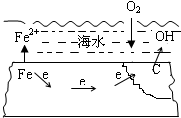

| A. | 该腐蚀过程为析氢腐蚀 | |
| B. | 正极的反应为:O2+2H2O+4e→4OH- | |
| C. | 碳上发生的是氧化反应 | |
| D. | 若该钢铁上焊有铜钉,其被腐蚀的速率将减小 |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 含0.1molHCl溶液中含氢元素0.1NA | |
| B. | 22.4 L 水蒸气含原子数为3NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 标准状况下,1mol辛烷含有的氢原子数为18NA |
1.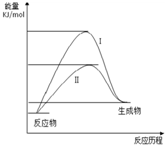 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
18.下列叙述正确的是( )
| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
12.下列关于Na2CO3和NaHCO3的说法正确的是( )
| A. | 与足量酸反应:离子方程式相同 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物质的量与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |