题目内容
12.关于阿佛加德罗常数NA的叙述中,正确的是( )| A. | 10 g H218O中所含的中子数为5NA | |
| B. | 1 mol 铁单质与足量的硫单质充分反应,电子转移数目为3NA | |
| C. | 在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数小于0.2NA | |
| D. | 一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA |
分析 A.质量转化为物质的量,结合1个 H218O含有10个中子解答;
B.铁与硫反应生成硫化亚铁;
C.NH4Cl溶液中,氯化铵、水都是电解质,都能电离生成离子;
D.氮气与氢气反应生成氨气为可逆反应.
解答 解:A.10 g H218O物质的量为$\frac{10g}{20g/mol}$=0.5mol,含有中子的物质的量=0.5mol×10=5mol,个数为5NA,故A正确;
B.1 mol 铁单质与足量的硫单质充分反应生成1molFeS,电子转移数目为2NA,故B错误;
C.在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数大于0.2NA,故C错误;
D.氮气与氢气反应生成氨气为可逆反应,可逆反应不能进行到底,所以一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA,故D正确;
故选:AD.
点评 本题考查物质的量的有关计算,为高频考点,侧重考查学生判断及计算能力,明确该分子构成是解本题关键,注意可逆反应特点,题目难度不大.

练习册系列答案
相关题目
20.25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是( )
| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
7.已知甲、乙、丙、X是中学化学中四种常见的物质,其转化关系如图所示.则甲和X不可能是( )
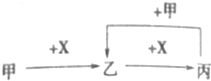
| A. | 甲为CO2,X为NaOH溶液 | B. | 甲为NH3,X为O2 | ||
| C. | 甲为Si,X为O2 | D. | 甲为NaAlO2,X为HCl溶液 |
17.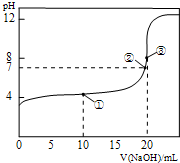 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )| A. | 点①所示溶液:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | 点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+ ) |
4.钢铁在海水中的腐蚀过程如图所示,有关说法正确的是( )
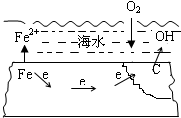

| A. | 该腐蚀过程为析氢腐蚀 | |
| B. | 正极的反应为:O2+2H2O+4e→4OH- | |
| C. | 碳上发生的是氧化反应 | |
| D. | 若该钢铁上焊有铜钉,其被腐蚀的速率将减小 |
1.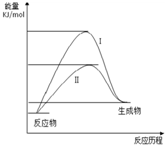 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
2.某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
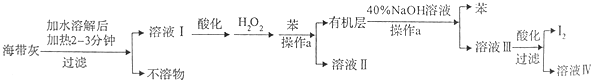
(1)溶解海带灰时要加热煮沸2~3min的目的是加快I-溶解,使海带灰中I-尽可能全部溶解,操作a的名称为分液.
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2.
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式3I2+6NaOH=NaIO3+5NaI+3H2O.
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是C(填选项字母).
A.水 B.乙醇 C.冷水 D.乙醇的水溶液
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g产品,配制成100ml溶液.取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0,.050mol•L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示.
滴定时,达到滴定终点的现象是加入最后一滴标准溶液后,蓝色溶液恰好变为无色且半分钟内不褪色,碘单质在产品中的质量分数是25.4%(用百分数表示,且保留1位小数).

(1)溶解海带灰时要加热煮沸2~3min的目的是加快I-溶解,使海带灰中I-尽可能全部溶解,操作a的名称为分液.
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2.
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式3I2+6NaOH=NaIO3+5NaI+3H2O.
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是C(填选项字母).
A.水 B.乙醇 C.冷水 D.乙醇的水溶液
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g产品,配制成100ml溶液.取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0,.050mol•L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |