题目内容
10. 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
分析 A.a点为硫酸铵溶液,铵根离子水解,溶液呈酸性,则c(H+)>c(OH-);
B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断;
C.c点溶液中存在电荷守恒和物料守恒,根据电荷守恒、物料守恒判断;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半.
解答 解:A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42-),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3•H2O)=2c(SO42-)=2c(Na+),所以得c(SO42-)+c(H+)=c(NH3•H2O )+c(OH-),故C正确;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3•H2O )>c(SO42-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断及离子浓度大小比较,题目难度中等,明确图象中曲线变化趋势、曲线上每一个点的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒来分析解答,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
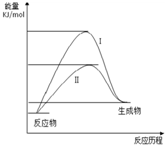 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
| A. | 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 | |
| B. | pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 | |
| C. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| D. | 石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 |
| A. | Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 | |
| D. | 钠与氧气反应的产物与反应条件无关 |
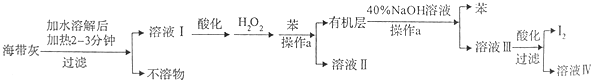
(1)溶解海带灰时要加热煮沸2~3min的目的是加快I-溶解,使海带灰中I-尽可能全部溶解,操作a的名称为分液.
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2.
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式3I2+6NaOH=NaIO3+5NaI+3H2O.
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是C(填选项字母).
A.水 B.乙醇 C.冷水 D.乙醇的水溶液
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g产品,配制成100ml溶液.取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0,.050mol•L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |
| A. | 与足量酸反应:离子方程式相同 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物质的量与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |