题目内容
11.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )| A. | 碳酸钠溶液 | B. | 氢氧化钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
分析 适当降低氢离子浓度、将Zn换为不如Zn活泼且能与氢离子反应生成氢气的金属能减缓反应速率,不影响生成氢气总量,则酸最终电离出氢离子总量不变,以此解答该题.
解答 解:A.加入碳酸钠,消耗硫酸,生成氢气的量减少,故A错误;
B.加入氢氧化钠,发生中和反应,消耗硫酸,生成氢气的总量减小,故B错误;
C.加入硫酸钾溶液,氢离子浓度减小,反应速率降低,但最终电离出氢离子物质的量不变,则生成氢气总量不变,故C正确;
D.加入硝酸钠溶液,硝酸和锌反应不生成氢气而生成氮氧化物,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、物质性质是解本题关键,易错选项是D,注意D中隐含条件,题目难度不大.

练习册系列答案
相关题目
20.目前,已经合成了LiH、NaH、CaH2、MgH2(AlH3)n等,下列说法不正确的是( )
| A. | 金属氢化物都是强还原剂 | |
| B. | 金属与H2制备金属氢化合物时,H2作还原剂 | |
| C. | 金属氢化物与水反应生成对应的碱和H2 | |
| D. | 离子半径:r(H-)>r(Li+) |
16.现有两种烯烃:CH2=CH2和 它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的( )
它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的( )

 它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的( )
它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的( )
| A. | ①③④ | B. | ③ | C. | ②③ | D. | ①②④ |
20.25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是( )
| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
1.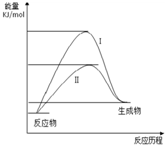 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |