题目内容
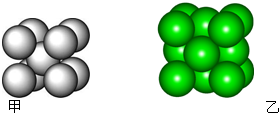 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.(1)乙的堆积方式称为
(2)在T℃以下测定该金属晶体有关性质参数如下表所示.已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量.
| 金属 | 相对原子质量 | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | 0.960 | 108.4 |
| M | 60.20 | 7.407 | 7735 |
| 3 |
| 200 |
| 7 |
考点:晶胞的计算,金属晶体的基本堆积模型
专题:化学键与晶体结构
分析:(1)乙的堆积模式是面心立方最密堆积;甲中的配位数是8、乙中的配位数是12;甲通过体心的对角线长为原子半径的4倍、乙正方形对角线长为原子半径的4倍;
(2)在T℃以下时,该晶体模型为甲型,金属晶体的原子化热越大,其熔点越高;该晶胞中M原子个数=1+8×
=2,根据ρ=
计算M原子半径.
(2)在T℃以下时,该晶体模型为甲型,金属晶体的原子化热越大,其熔点越高;该晶胞中M原子个数=1+8×
| 1 |
| 8 |
| m |
| V |
解答:
解:(1)乙的晶胞中每个顶点上含有一个金属原子、每个面心上含有一个金属原子,所以乙的堆积模式是面心立方最密堆积;甲中的配位数是8、乙中金属原子的配位数=3×8×
=12,所以甲、乙的配位数之比=8:2=2::3;甲通过体心的对角线长为原子半径的4倍、乙正方形对角线长为原子半径的4倍,设原子半径为r,甲中边长=
r,乙中边长=2
r,则甲乙晶胞的边长之比=
r:2
r=
:3,
故答案为:面心立方最密;2:3;
:3;
(2)在T℃以下时,该晶体模型为甲型,金属晶体的原子化热越大,其熔点越高,M的原子化热大于Na,所以该金属的熔点比Na高;该晶胞中M原子个数=1+8×
=2,设原子半径为r,甲中边长=
r,体积为(
r)3,由ρ=
得V=
,则r=
cm=1.30cm=130pm,故答案为:高;130.
| 1 |
| 2 |
4
| ||
| 3 |
| 2 |
4
| ||
| 3 |
| 2 |
| 6 |
故答案为:面心立方最密;2:3;
| 6 |
(2)在T℃以下时,该晶体模型为甲型,金属晶体的原子化热越大,其熔点越高,M的原子化热大于Na,所以该金属的熔点比Na高;该晶胞中M原子个数=1+8×
| 1 |
| 8 |
4
| ||
| 3 |
4
| ||
| 3 |
| m |
| V |
| ||
| 7.407 |
| |||||||
|
点评:本题考查了晶胞的计算,涉及晶体堆积模型、配位数的计算、晶胞的计算等知识点,熟悉常见晶体模型是解本题关键,难点是晶胞的计算,注意甲、乙堆积模式的不同导致其晶胞中原子个数不同、边长不同,题目难度中等.

练习册系列答案
相关题目
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4-.某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X.下列关于该反应的描述中不正确的是( )
| A、X是H2SO4 |
| B、反应中Mn原子与Bi原子个数比为5:2 |
| C、该反应中NaBiO3作氧化剂 |
| D、该反应中Na2SO4既不是氧化产物,又不是还原产物 |
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务. 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表: