题目内容
根据下列提供的一组物质回答下列问题:HCl、NH4Cl、N2、NaOH、CaCl2、Cl2、NaF、CO2
(1)只含有离子键的离子化合物有 (填化学式,下同),属于共价化合物的有 .
(2)既含有离子键,又含有极性键的物质有 .
(3)含有非极性键的物质有 .
(1)只含有离子键的离子化合物有
(2)既含有离子键,又含有极性键的物质有
(3)含有非极性键的物质有
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型,极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,含有离子键的化合物是离子键化合物,如部分碱、大多数盐及金属氧化物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
解答:
解:HCl中H原子和Cl原子之间只存在极性共价键,为共价化合物;
NH4Cl中铵根离子和氯离子之间存在离子键,N原子和H原子之间存在极性键,为离子化合物;
N2中N原子之间存在非极性共价键,为单质;
NaOH中钠离子和氢氧根离子之间存在离子键,O原子和H原子之间存在极性键,为离子化合物;
CaCl2中钙离子和氯离子之间存在离子键,为离子化合物;
Cl2中Cl原子之间只存在非极性键,为单质;
NaF中氟离子和钠离子之间存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
(1)通过以上分析知,只含离子键的离子化合物为CaCl2、NaF,只含共价键的共价化合物为HCl、CO2,故答案为:CaCl2、NaF; HCl、CO2;
(2)既含有离子键,又含有极性键的物质有NH4Cl、NaOH,故答案为:NH4Cl、NaOH;
(3)含有非极性键的物质有N2、Cl2,故答案为:N2、Cl2.
NH4Cl中铵根离子和氯离子之间存在离子键,N原子和H原子之间存在极性键,为离子化合物;
N2中N原子之间存在非极性共价键,为单质;
NaOH中钠离子和氢氧根离子之间存在离子键,O原子和H原子之间存在极性键,为离子化合物;
CaCl2中钙离子和氯离子之间存在离子键,为离子化合物;
Cl2中Cl原子之间只存在非极性键,为单质;
NaF中氟离子和钠离子之间存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
(1)通过以上分析知,只含离子键的离子化合物为CaCl2、NaF,只含共价键的共价化合物为HCl、CO2,故答案为:CaCl2、NaF; HCl、CO2;
(2)既含有离子键,又含有极性键的物质有NH4Cl、NaOH,故答案为:NH4Cl、NaOH;
(3)含有非极性键的物质有N2、Cl2,故答案为:N2、Cl2.
点评:本题考查了离子键、共价键、离子化合物和共价化合物的判断,明确这几个概念的内涵是解本题关键,注意这几个概念的区别,注意不能根据是否含有金属元素判断离子键,如铵盐,为易错点.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
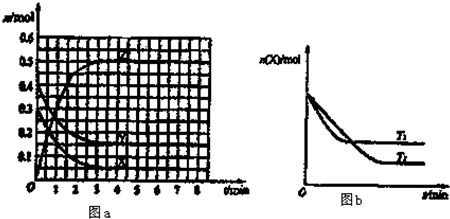

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
液态化合物AB会发生微弱的自身电离,电离方程式为AB?A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、AB的电离是吸热过程 |
| B、在35℃时,c(A+)>c(B-) |
| C、AB的电离程度(25℃)>(35℃) |
| D、c(A+)随温度升高而降低 |
下列有关实验说法正确的是( )
| A、在“阿司匹林的合成”实验中,把制得的粗产品置于烧杯中,搅拌并缓慢加入饱和碳酸氢钠溶液,将烧杯置于冰水中冷却,即有晶体析出,抽滤,洗涤晶体,再抽干水分以提纯产品 |
| B、酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
| C、在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| D、在实验室发生溴腐蚀致伤时,应先用苯或甘油洗伤口,再用水洗 |
鉴别二甲醚和乙醇可采用化学方法或物理方法,下列方法不能对二者进行鉴别的是( )
| A、利用金属钠或金属钾法 |
| B、利用红外光谱法 |
| C、利用质谱法 |
| D、利用核磁共振氢谱法 |
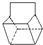 )是双环戊二烯的一种同分异构体,它的一氯代物有
)是双环戊二烯的一种同分异构体,它的一氯代物有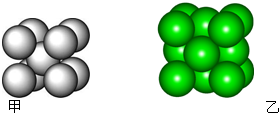 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.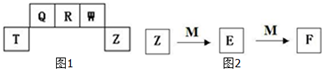 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题: