题目内容
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
考点:电解质在水溶液中的电离,物质的量浓度
专题:离子反应专题
分析:单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,根据溶液中的溶质的性质及数目解答.
解答:
解:假设溶液的体积都是1L,
A.1L0.01 mol?L-1的蔗糖溶液中蔗糖的物质的量=0.01mol/L×1L=0.01mol;
B.1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
C.1L0.01 mol?L-1的NaCl溶液溶液中离子的总物质的量=1L×0.01mol/L×2=0.02mol;
D.因CH3COOH是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol,
所以离子物质的量最多的是氯化钙溶液,则沸点最高是氯化钙溶液,故选B.
A.1L0.01 mol?L-1的蔗糖溶液中蔗糖的物质的量=0.01mol/L×1L=0.01mol;
B.1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
C.1L0.01 mol?L-1的NaCl溶液溶液中离子的总物质的量=1L×0.01mol/L×2=0.02mol;
D.因CH3COOH是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol,
所以离子物质的量最多的是氯化钙溶液,则沸点最高是氯化钙溶液,故选B.
点评:本题考查了物质的沸点与溶质的关系,涉及物质的量的计算及物质的性质,知道常见挥发性物质,理解题干信息,题目难度不大.

练习册系列答案
相关题目
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )①镁为正极
②电子由铝片通过导线流向镁片
③该电池的内电路中,阳离子向负极迁移
④镁片上发生的反应为:Mg-2e-═Mg2+
⑤该装置能够将电能转化为化学能
⑥负极反应为 Al-3e-+4OH-═AlO2-+2H2O
⑦正极发生还原反应,负极发生氧化反应
⑧Al是电池负极,开始工作时溶液中会立即有白色沉淀析出.
| A、①②⑦⑧ | B、③④⑤⑥ |
| C、①②⑥⑦ | D、②③⑤⑧ |
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
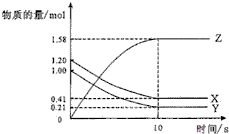 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )| A、维生素A的分子式为C18H28O |
| B、一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C、维生素A可使溴水褪色 |
| D、1mol维生素A分子最多可跟5 mol H2发生加成反应 |
实验室可提供下列实验操作:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化.如要鉴定1-氯丙烷中的氯元素,从中选择合适的操作步骤是( )
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
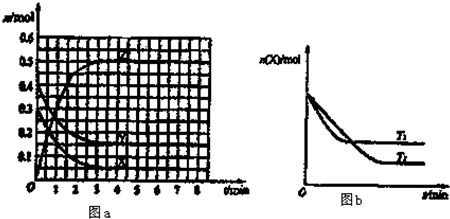

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
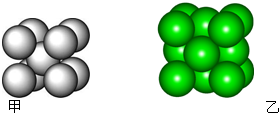 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.