题目内容
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol.
①反应开始至达到平衡的过程中,容器中下列各项发生变化的是
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
②在T℃时,该反应的平衡常数K=
③假设容器体积为5L,则5min内该反应的平均速率υ(NO)=
(2)H2或CO可以催化还原NO以达到消除污染的目的.
①已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.则该反应的△H
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)①a.混合气体的总质量不变,容器的体积不变,据此判断;
b.混合气体总的物质的量不变,容器体积不变,据此判断;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大;
②利用三段法“开始 变化 平衡”列出各组分数据,代入化学平衡常数表达式计算;
③利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率计算;
(2)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;根据自发反应进行的判断公式判断;
②根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
b.混合气体总的物质的量不变,容器体积不变,据此判断;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大;
②利用三段法“开始 变化 平衡”列出各组分数据,代入化学平衡常数表达式计算;
③利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率计算;
(2)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;根据自发反应进行的判断公式判断;
②根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
解答:
解:(1)①a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.混合气体总的物质的量不变,容器体积不变,混合气体的压强不变,故b不符合;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低,故c符合;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,
故单位时间内,N2的消耗量减小,NO的消耗量增大,单位时间内,N2和NO的消耗量之比减小,故d符合;
故答案为:cd;
②由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
K=
=
=1.25,故答案为:1.25;
③υ(NO)=
=0.2mol/(L?min),故答案为:0.2mol/(L?min);
(2)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol;由于正反应放热(△H<0),且正反应方向气体体积减小,为熵减小的方向,即△S<0,△H-T?△S<0,反应自发进行,所以T较小才可以,即低温下自发,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;低温自发;
(3)②温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0;催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: ;故答案为:<、
;故答案为:<、 .
.
b.混合气体总的物质的量不变,容器体积不变,混合气体的压强不变,故b不符合;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低,故c符合;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,
故单位时间内,N2的消耗量减小,NO的消耗量增大,单位时间内,N2和NO的消耗量之比减小,故d符合;
故答案为:cd;
②由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
K=
| c2(NO) |
| c(N2)?c(O2) |
| 1.02 |
| 0.8×1.0 |
③υ(NO)=
| 1.0mol/L |
| 5min |
(2)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol;由于正反应放热(△H<0),且正反应方向气体体积减小,为熵减小的方向,即△S<0,△H-T?△S<0,反应自发进行,所以T较小才可以,即低温下自发,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;低温自发;
(3)②温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0;催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为:
 ;故答案为:<、
;故答案为:<、 .
.
点评:本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,难度不大,(3)中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
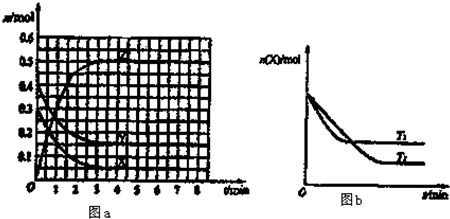

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
下列有关实验说法正确的是( )
| A、在“阿司匹林的合成”实验中,把制得的粗产品置于烧杯中,搅拌并缓慢加入饱和碳酸氢钠溶液,将烧杯置于冰水中冷却,即有晶体析出,抽滤,洗涤晶体,再抽干水分以提纯产品 |
| B、酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
| C、在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| D、在实验室发生溴腐蚀致伤时,应先用苯或甘油洗伤口,再用水洗 |
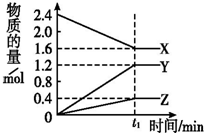 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知: )是双环戊二烯的一种同分异构体,它的一氯代物有
)是双环戊二烯的一种同分异构体,它的一氯代物有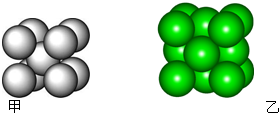 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.