题目内容
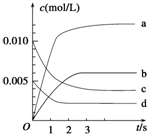 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的变化的曲线是
(2)能说明该反应已达到平衡状态的是
a.2v逆(NO2)=v正(O2)b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);根据v=
计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
| △c |
| △t |
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
解答:
(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=
=0.0065mol/L,所以图中表示NO2变化的曲线是b,2s内用NO表示的平均反应速率v(NO)=
=
=3.0×10-3mol?L-1?s-1,速率之比等于化学计量数之比,
所以v(O2)=
v(NO)=
×3.0×10-3mol?L-1?s-1=1.5×10-3mol?L-1?s-1,
故答案为:b;1.5×10-3;
(2)a、当2v逆(NO2)=v正(O2)时,该反应未达平衡状态,而当v逆(NO2)=2v正(O2)时,反应才处于平衡状态,故a错误;
b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故容器内压强保持不变时,反应达到平衡状态,故b正确;
c、v逆(NO):v正(O2)=2:1时,正逆反应速率相等,该反应达到平衡状态,故c正确;
d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
故答案为:bc;
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故a错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;
故答案为:c.
| 0.020mol-0.007mol |
| 2L |
| ||
| △t |
| ||
| 2s |
所以v(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:b;1.5×10-3;
(2)a、当2v逆(NO2)=v正(O2)时,该反应未达平衡状态,而当v逆(NO2)=2v正(O2)时,反应才处于平衡状态,故a错误;
b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故容器内压强保持不变时,反应达到平衡状态,故b正确;
c、v逆(NO):v正(O2)=2:1时,正逆反应速率相等,该反应达到平衡状态,故c正确;
d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
故答案为:bc;
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故a错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;
故答案为:c.
点评:本题考查了化学平衡状态的判断、化学反应速率的计算等知识点,难度不大,注意催化剂只改变反应速率,但不影响平衡移动,为易错点.

练习册系列答案
相关题目
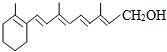 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )| A、维生素A的分子式为C18H28O |
| B、一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C、维生素A可使溴水褪色 |
| D、1mol维生素A分子最多可跟5 mol H2发生加成反应 |
液态化合物AB会发生微弱的自身电离,电离方程式为AB?A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、AB的电离是吸热过程 |
| B、在35℃时,c(A+)>c(B-) |
| C、AB的电离程度(25℃)>(35℃) |
| D、c(A+)随温度升高而降低 |
有Fe2+、NO3-、Fe3+、NH4+、H+、H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A、氧化剂中心原子的杂化方式为sp2 |
| B、还原剂的外围电子排布式为3d54s1 |
| C、还原产物的VSEPR模型为正四面体 |
| D、该反应可设计为原电池,其负极反应为Fe2+-e-=Fe3+ |
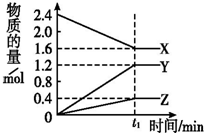 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: )是双环戊二烯的一种同分异构体,它的一氯代物有
)是双环戊二烯的一种同分异构体,它的一氯代物有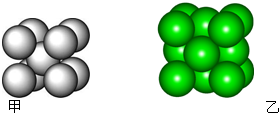 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同. 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题: