题目内容
2.448mL某气体在标准状况下的质量为0.64g,该气体的摩尔质量约为( )| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |
分析 依据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,依据M=$\frac{m}{M}$计算其摩尔质量.
解答 解:在标准状况下的448ml某气体的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,其摩尔质量M=$\frac{0.64g}{0.02mol}$=32g/mol;
故选D.
点评 本题考查了物质的量的有关计算,明确以物质的量为核心的相关计算公式、明确摩尔质量的单位是解题关键,题目难度不大.

练习册系列答案
相关题目
12.下列表述中正确的是( )
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
10.下列关于物质分类的正确组合是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸CH3COOH | 胆矾 CuSO4•5H2O | 过氧化钠 | 二氧化硫 |
| D | NH3•H2O | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
17.维生素C又称“抗坏血酸”,能将人体不易吸收的Fe3+转化为Fe2+,这说明维C是( )
| A. | 电解质 | B. | 氧化剂 | C. | 还原剂 | D. | 胶体 |
7.下列说法正确的是( )
| A. | NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42- NaHCO3在水中的电离方程式为:NaHCO3=Na++H++CO32- | |
| B. | NaCl溶液能导电是因为溶液中有能自由移动的Na+和Cl- | |
| C. | 液态氯化氢和稀盐酸一样可以导电 | |
| D. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加入盐酸,沉淀不消失,则原溶液中一定含有SO42- |
14.将V1ml 1.00mol/LHCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50ml),下列叙述正确的是( )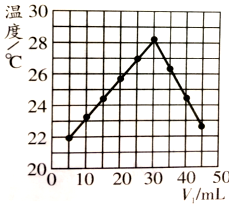

| A. | 实验操作时的环境温度为22℃ | |
| B. | 实验表明热能可转化为化学能 | |
| C. | 该实验表明有水生成的反应都是放热反应 | |
| D. | NaOH溶液的浓度约为1.50 mol/L |
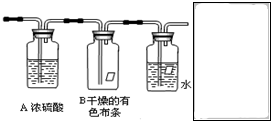 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.