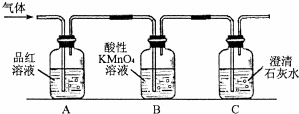
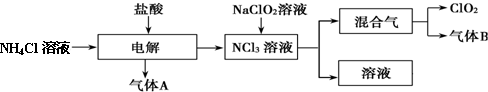
题目内容
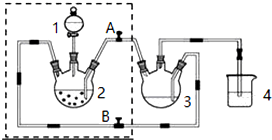
18. 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.已知:I2+Na2CO3═NaI+NaIO+CO2↑;△H<0
3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0
I2(s)+I-(aq)═I3-(aq);
水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2(放热反应);100℃左右水合肼分解为氮气和氨气等.
(1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是abc(填字母).
a.将碘块研成粉末 b.起始时加少量NaI
c.将溶液适当加热 d.加大高纯水的用量
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,除防止反应速率过快,另一个原因是防止碘升华.
(3)写出水合肼氧化IO-的离子方程式2IO-+N2H4.H2O=2I-+N2↑+3H2O或2IO3-+3N2N4.H2O=2I-+3N2↑+9H2O.
(4)所得溶液(偏黄,且含少量SO42-,极少量的K+和Cl-)进行脱色、提纯并结晶,可制得高纯NaI晶体.实验方案为:
①、将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2 CO3溶液、过滤,在滤液中加少量活性炭煮沸后趁热过滤(填操作名称),这样操作的目的是除去活性炭,并防止温度降低NaI结晶析出降低产率.
②、溶液在不断搅拌下加入(填试剂名称)至溶液的PH约为6,然后冷却结晶(填操作名称),再次过滤,用洗涤晶体2~3次,在真空干燥箱中干燥.
分析 (1)增大反应物浓度、反应物接触面积及升高温度、加入催化剂都能加快反应速率;
(2)温度高时碘易升华;
(3)水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2;
(4)将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2 CO3溶液、过滤,氢氧化钡除去硫酸根离子、碳酸钠除去钡离子,NaI的溶解性和NaCl相似,温度越高其溶解度越大,为防止NaI结晶析出,应该趁热过滤;
②溶液在不断搅拌下加入HI至溶液的PH约为6,HI用于除去过量的碳酸钠,然后冷却结晶,再次过滤,洗涤晶体2~3次,在真空干燥箱中干燥.
解答 解:(1)增大反应物浓度、反应物接触面积及升高温度都能加快反应速率,
a.将碘块研成粉末,增大反应物接触面积,加快反应速率,故a选;
b.根据方程式①②知,NaI相当于催化剂,能加快反应速率,故b选;
c.将溶液适当加热,增大活化分子百分数,反应速率加快,故c选;
d.加大高纯水的用量,降低单位体积内活化分子个数,降低反应速率,故d不选;
故选abc,
故答案为:abc;
(2)温度越高反应速率越快,但温度高时碘易升华,所以温度不宜超过70℃,
故答案为:防止碘升华;
(3)水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2,
其中一个反应方程式为2IO-+N2H4.H2O=2I-+N2↑+3H2O或2IO3-+3N2N4.H2O=2I-+3N2↑+9H2O,
故答案为:2IO-+N2H4.H2O=2I-+N2↑+3H2O或2IO3-+3N2N4.H2O=2I-+3N2↑+9H2O;
(4)将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2 CO3溶液、过滤,氢氧化钡除去硫酸根离子、碳酸钠除去钡离子,NaI的溶解性和NaCl相似,温度越高其溶解度越大,为防止NaI结晶析出而导致NaI产率降低,所以应该趁热过滤,
故答案为:趁热过滤;除去活性炭,并防止温度降低NaI结晶析出降低产率;
②溶液在不断搅拌下加入HI至溶液的PH约为6,HI用于除去过量的碳酸钠且不引进新的杂质,然后冷却结晶,再次用高纯水过滤,洗涤晶体2~3次,在真空干燥箱中干燥,从而得到纯净、干燥的NaI,
故答案为:HI溶液;冷却结晶;高纯水.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、获取题给信息并分析解答问题能力,明确实验操作规范性、元素化合物性质、化学反应原理是解本题关键,注意题给信息的正确、灵活运用,题目难度中等.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |

| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
Ⅰ.称取一定量的铁屑于锥形瓶中,加入过量的6mol•L-1的盐酸,在通风橱中充分反应;
Ⅱ.根据FeCl2的理论产量,加入足量的氧化剂X;
Ⅲ.FeCl3溶液通过一系列操作制得无水FeCl3.
已知:不同温度下六水合FeCl3在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
(1)请选择本实验中合适的氧化剂XCD.
A.KMnO4(H+) B.稀硝酸 C.H2O2 D.Cl2
(2)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:
①加入盐酸后,②蒸发浓缩、冷却结晶,③过滤、洗涤,④干燥.
(3)过滤后用少量乙醇洗涤FeCl3•6H2O晶体,选用乙醇的原因是洗去晶体表面的水,减少氯化铁晶体的溶解损耗.
(4)FeCl3的质量分数通常可用碘量法测定:
称取m g无水FeCl3样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①配制FeCl3溶液所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需100mL容量瓶;
②在FeCl3质量分数测定的实验过程中,下列说法正确的是CD.
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中FeCl3的质量分数的测量结果偏高
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③滴定终点的现象是:溶液由蓝色变无色,且半分钟内不变色,样品中FeCl3的质量分数$\frac{162.5cV}{m}%$.
| A. | 从反应开始到达到平衡,所需时间tM>tN | |
| B. | 平衡时cM(I2)=c N(I2) | |
| C. | 平衡时I2 蒸气在混合气体中的体积分数:M>N | |
| D. | HI的平衡分解率αM=αN |