题目内容
12.下列表述中正确的是( )| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
分析 A.反应自发与否决定于焓变和熵变两个因素;
B.燃烧热指101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量;
C.反应热等于反应物的键能总和与生成物的键能总和之差;
D.1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应均生成1mol水.
解答 解:A.反应自发与否决定于焓变和熵变两个因素,放热的熵减小的反应高温下不能自发进行,故A错误;
B.燃烧热指的是在101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,故水应为液态,故B错误;
C.反应热等于反应物的键能总和与生成物的键能总和之差,所以反应热的大小与反应物和生成物的键能有关,故C错误;
D.1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应均生成1mol水,反应放热为57.3kJ,放出的热量相等,故D正确.
故选D.
点评 本题考查了反应热与焓变、反应自发进行的判断、键能与反应热的关系等,题目难度不大,注重把握燃烧热和中和热的概念,试题有利于培养学生的分析、理解能力.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
3.从海水中提取部分物质的过程如图所示,下列有关说法错误的是( )
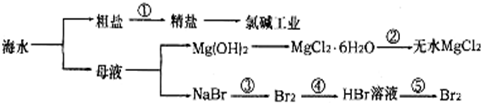

| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
20.如图纵坐标为反应物的转化率,横坐标为温度(t℃),下列符合此图情况的反应是( )
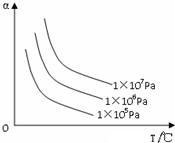

| A. | C(s)+CO2(g)?2CO(g);△H>0 | B. | H2(g)+Br2(g)?2HBr(g);△H<0 | ||
| C. | N2(g)+3H2(g)?2NH3(g);△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g);△H>0 |
7.低温脱硝技术可用于处理废气中的氮氧化物发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$?_{催化剂}^{180℃}$
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
17.对于平衡体系:aA(g)+bB(g)?cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d | |
| B. | 若反应开始容器中只有A和B,平衡时,A、B的转化率相等,则A、B的物质的量之比为1:1 | |
| C. | 若平衡体系中共有气体xmol,再向其中充入bmolB,达到平衡时气体总物质的量为(x+b)mol,则a+b=c+d | |
| D. | 若a+b=c+d,升高温度时,A的体积分数不变 |
4.在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列判断正确的是( )
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
2.448mL某气体在标准状况下的质量为0.64g,该气体的摩尔质量约为( )
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |