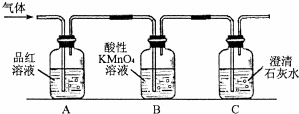
题目内容
13.我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的.粗盐中的Ca2+、Mg2+、SO42- 以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:①加适量盐酸; ②加过量Na2CO3溶液; ③过滤;④加过量NaOH溶液; ⑤加过量BaCl2溶液.
(1)以上正确的操作顺序为:⑤②④③①(或⑤④②③①或④⑤②③①).
(2)步骤⑤判断BaCl2溶液过量的实验操作方法是取少量上层清液于试管中,加入BaCl2溶液,如果没有白色沉淀生成,则说明BaCl2溶液已过量.
(3)步骤③实验中所用的玻璃仪器有烧杯、玻璃棒、漏斗.
(4)其中,在步骤①中涉及的离子反应方程式有H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(5)除杂操作完成后,得到NaCl固体操作方法为蒸发结晶.
(6)m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为D.
A.m>n B.m<n C.m=n D.无法确定.
分析 (1)在粗盐提纯时,要在最后一步加入盐酸,除去过量的氢氧根离子和碳酸根离子,碳酸钠加在氯化钡的后面,除去钙离子和加入的过量的钡离子,NaOH溶液除镁离子,顺序在过滤前即可;
(2)判断BaCl2溶液过量说明溶液中没有硫酸根离子,据此分析检验;
(3)步骤③过滤所用的玻璃仪器有烧杯、玻璃棒和漏斗;
(4)步骤①加适量盐酸,除去过量的氢氧根和碳酸根;
(5)除杂操作完成后,由NaCl溶液得到NaCl固体操作方法为蒸发结晶.
(6)粗盐提纯过程中即加入了钠离子液加入了氯离子分析判断.
解答 解:(1)在粗盐提纯时,要在最后一步加入盐酸,除去过量的氢氧根离子和碳酸根离子,碳酸钠加在氯化钡的后面,除去钙离子和加入的过量的钡离子,NaOH溶液除镁离子,顺序在过滤前即可,所以正确的操作顺序为:⑤②④③①(或⑤④②③①或④⑤②③①);故答案为:⑤②④③①(或⑤④②③①或④⑤②③①);
(2)BaCl2溶液过量说明溶液中没有硫酸根离子,则取少量上层清液于试管中,加入BaCl2溶液,如果没有白色沉淀生成,则说明BaCl2溶液已过量;故答案为:取少量上层清液于试管中,加入BaCl2溶液,如果没有白色沉淀生成,则说明BaCl2溶液已过量;
(3)步骤③过滤所用的玻璃仪器有烧杯、玻璃棒和漏斗;故答案为:玻璃棒、漏斗;
(4)步骤①加适量盐酸,除去过量的氢氧根和碳酸根,则发生的离子反应为H++OH-=H2O、2H++CO32-=H2O+CO2↑,故答案为:H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(5)除杂操作完成后,由NaCl溶液得到NaCl固体操作方法为蒸发结晶,故答案为:蒸发结晶;
(6)粗盐提纯过程中即加入了钠离子液加入了氯离子,m与n的大小关系不能确定大小;
故答案为:D.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握除杂的原理和操作方法,难度不大.

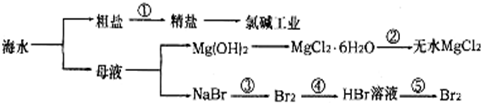
| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
| A. | 加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 某溶液中加入硝酸银溶液生成白色沉淀,说明溶液中有Cl- | |
| D. | 无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |