题目内容
3.恒温恒容密闭容器中,能够表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡的是( )①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC.
| A. | ①②③ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①两边气体计量数相等,混合气体的压强始终不变,故错误;
②混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故正确;
③B的物质的量浓度不变,生成B的物质的量不变,正逆反应速率相等,故正确;
④当体系达平衡状态时,容器内B、C、D三种气体的浓度比可能为3:2:1,也可能不是,故错误;
⑤混合气体的相对分子质量不变,说明气体的质量不变,反应达平衡状态,故正确;
⑥消耗3molB的同时生成2molC,都体现正反应方向,故错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
13.相同质量的水在固态、液态和气态时所具有的能量从高到低的顺序是( )
| A. | 固态>液态>气态 | B. | 液态>固态>气态 | C. | 气态>液态>固态 | D. | 气态>固态>液态 |
14.热电池是一种可长期储备电能的电池,高氯酸钾广泛用于热电池.铁和高氯酸钾反应提供的能量使盐熔化导电,从而激活电池.铁和高氯酸钾的热电池反应为KClO4(s)+4Fe(s)═KCl(s)+4FeO(s)△H下列说法正确的是( )
| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
11.以下的说法中错误的是( )
| A. | 无论乙烯的加成,还是乙烷的取代反应都可制得溴乙烷 | |
| B. | 无论使用溴水或KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
8.苯乙酸的同分异构体中属于芳香酯的有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 10种 |
10.如图表示298K时N2与H2反应过程中的能量变化.
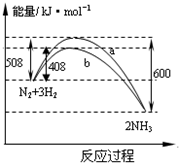
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 曲线b表明加入催化剂降低了反应热,加快了反应速率 | |
| C. | 加入催化剂,生成1molNH3的反应热减小50KJ | |
| D. | 不用催化剂,生成1molNH3放出的热量为46KJ |
 .
. ,C的最高价氧化物水化物的电子式
,C的最高价氧化物水化物的电子式 ,淡黄色的固体E的电子式
,淡黄色的固体E的电子式 .
.
 .
. .
.