题目内容
15.下表是元素周期表的一部分(短周期),针对表中用字母标出的元素,除特别说明外,按要求用化学用语回答下列问题:

(1)在这些元素中,化学性质最不活泼的是Ar(填具体元素符号),其原子结构示意图为
 .
.(2)表中K代表的元素名称为氯,其在周期表中的位置为第三周期ⅦA族.
(3)某元素原子M层电子数是第一层电子数的2倍,另一元素原子最外层电子数是次外层电子数的3倍,二者形成的化合物的化学式是SiO2.
(4)最高价氧化物的水化物中碱性最强的化合物的电子式是
 .
.(5)GA3和HA3中沸点较高的是NH3(填具体化学式),GA3的水溶液呈碱性,D的简单阳离子和该水溶液反应的离子方程式是Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
分析 由元素在周期表中位置,可知A为氢,B为Na,C为Mg,D为Al,E为碳,F为Si,G为氮,H为磷,I为氧,J为硫,K为Cl,L为Ar.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;
(2)由元素位置可知K处于第三周期ⅦA族,为氯元素;
(3)某元素原子M层电子数是第一层电子数的2倍,该元素为Si,另一元素原子最外层电子数是次外层电子数的3倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则该元素为O元素;
(4)最高价氧化物的水化物中碱性最强的化合物为NaOH;
(5)分子之间形成氢键,使物质的沸点升高;氨水呈碱性;铝离子与一水合氨反应生成氢氧化铝沉淀与铵根离子.
解答 解:由元素在周期表中位置,可知A为氢,B为Na,C为Mg,D为Al,E为碳,F为Si,G为氮,H为磷,I为氧,J为硫,K为Cl,L为Ar.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,其原子结构示意图为: ,
,
故答案为:Ar; ;
;
(2)由元素位置可知K处于第三周期ⅦA族,为氯元素,
故答案为:氯;第三周期ⅦA族;
(3)某元素原子M层电子数是第一层电子数的2倍,该元素为Si,另一元素原子最外层电子数是次外层电子数的3倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则该元素为O元素,二者形成的化合物为SiO2,
故答案为:SiO2;
(4)最高价氧化物的水化物中碱性最强的化合物为NaOH,其电子式为 ,
,
故答案为: ;
;
(5)氨气分子之间形成氢键,沸点高于PH3的,NH3的水溶液呈碱性,Al3+和该水溶液反应的离子方程式是Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
故答案为:NH3;碱;Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
点评 本题考查元素周期表、结构与位置关系、常用化学用语等,熟练掌握元素周期表的结构,注意氢键对物质性质的影响.

①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC.
| A. | ①②③ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑥ |
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平左边托盘上 | |
| C. | 用镊子取出标定为10.1 g的砝码放在天平右边的托盘上 | |
| D. | 用镊子取出标定为10 g的砝码放在天平左边的托盘上,并将游码向右移到0.1 g位置上 |
| A. | ${\;}_{8}^{18}$O,${\;}_{8}^{17}$O | B. | O2,O3 | C. | Fe3+,Fe2+ | D. | ${\;}_{6}^{12}$C,${\;}_{6}^{13}$C |
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素原子的最外层电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知: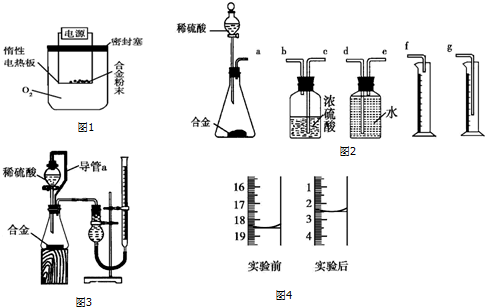
 实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:
实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下: