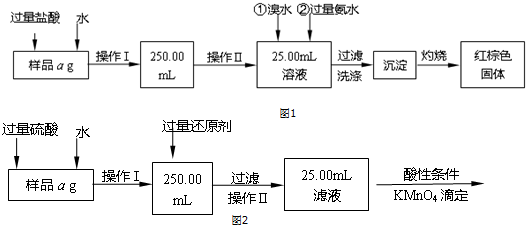
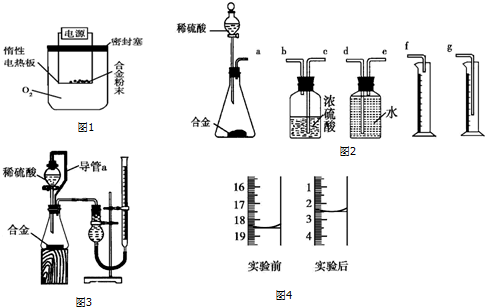
题目内容
14.热电池是一种可长期储备电能的电池,高氯酸钾广泛用于热电池.铁和高氯酸钾反应提供的能量使盐熔化导电,从而激活电池.铁和高氯酸钾的热电池反应为KClO4(s)+4Fe(s)═KCl(s)+4FeO(s)△H下列说法正确的是( )| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
分析 A.原电池的正极发生还原反应;
B.原电池的负极上发生失电子的氧化反应;
C.原电池是一个自发进行的放热反应,化学反应焓变数值和参与反应物的量无关;
D.根据化合价的升降情况来确定电子转移数目.
解答 解:A.原电池的正极发生还原反应,熔融盐可传递氧离子,正极反应式为KClO4(s)+8e-═KCl(s)+4O2-(l),故A正确;
B.铁为负极,发生氧化反应,故B错误;
C.原电池是一个自发进行的放热反应,则△H<0,但热化学方程式中反应热值只与化学计量数有关,和参与反应物的量无关,故C错误;
D.根据热电池反应:KClO4(s)+4Fe(s)═KCl(s)+4FeO(s),生成1 molFeO转移2mol电子,故D错误;
故选A.
点评 本题考查学生原电池的工作原理以及电极方程式的书写知识,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
9.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )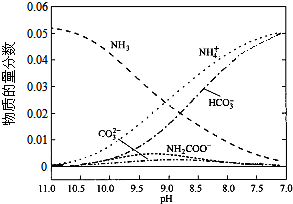

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
19.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 硅胶多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 |
3.恒温恒容密闭容器中,能够表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡的是( )
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC.
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC.
| A. | ①②③ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑥ |
4.元素的性质随着原子序数的递增呈现周期性变化的原因是( )
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素原子的最外层电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
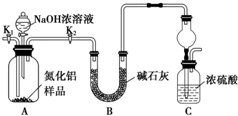
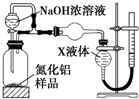
 d.NH4Cl溶液
d.NH4Cl溶液
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知: