题目内容
3.下列实验操作、现象与所得结论一致的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射 | 溶液变红褐色,出现 丁达尔效应 | 产生了 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该方法获得的为氢氧化铁胶体,具有丁达尔效应;
B.溶液变蓝,说明生成了碘单质,证明铁离子的氧化性大于碘单质;
C.挥发出的乙醇能够使酸性高锰酸钾溶液褪色,干扰了检验结果;
D.氯化钡呈中性,溶液褪色原因是碳酸根离子与钡离子生成了碳酸钡,溶液碱性减弱.
解答 解:A.向沸水中滴入几滴FeCl3饱和溶液,继续煮沸溶液变红褐色,得到氢氧化铁胶体,用激光笔照射,出现丁达尔效应,故A正确;
B.向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝说明生成了碘单质,则氧化性:Fe3+>I2,故B正确;
C.将溴乙烷和NaOH的乙醇溶液混合加热,产生气体中含有乙醇,乙醇能够是酸性KMnO4溶液,所以溶液褪色无法证明生成了乙烯,故C错误;
D.向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液,二者反应生成碳酸钡沉淀和氯化钠,碳酸根离子浓度减小之至消失,则溶液碱性逐渐减弱,导致溶液红色褪去,而氯化钡溶液呈中性,故D错误;
故选AB.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及胶体制备与性质、氧化还原反应、盐的水解原理、气体检验等知识,明确氧化性强弱比较方法为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.向分别含1molNaOH和1molBa(OH)2的混合溶液中通入amolCO2,下列说法不正确的是( )
| A. | 当a=l.0时,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当a=2时,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O | |
| C. | 当a=2.5时,反应的离子方程式为:OH-+CO2═HCO3- | |
| D. | 当a=1.75时,溶液中HCO3-与CO32-的物质的量之比为2:1 |
11.下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是( )
| 选项 | 实验器材 | 相应实验 |
| A | 试管、铁架台、导管、酒精灯 | 乙酸乙酯的制备 |
| B | 锥形瓶、漏斗、双孔塞、导管、带余烬的木条、药匙 | 检验MnO2对H2O2分解速率的影响 |
| C | 500mL容量瓶、烧杯、玻璃棒、天平 | 配制 500mL1.00mol/LNaCl溶液 |
| D | 三脚架、坩埚、酒精灯、坩埚钳 | 钠在空气中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
9.Na2O2是强氧化剂,也是航天航空、水下作业的供氧剂.
(1)Na2O2作供氧剂时,主要与人呼出的CO2反应,写出该反应的化学方程式,并用双线桥标明电子转移的方向和数目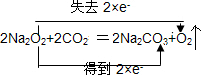 .
.
(2)航空和水下作业有时也会产生污染性气体,某学习小组欲探究Na2o2能否完全吸收氮氧化物、硫氧化物等污染性气体,设计了如下装置(未画完):
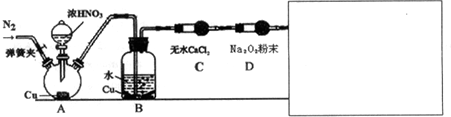
【资料信息】①酸性条件下,NO和NO2都能与MnO4-(H+)反应生成NO3-和Mn2+
②稀硝酸与Cu反应缓慢 ③2NO+Na2O2=2NaNO2
请在答题卷方框内补充完整装置示意图,并做必要标注.补充装置的作用是检验污染气体是否完全被Na2O2吸收,同时可防止污染气体排放到空气中.
(3)该学习小组中甲、乙、丙三位同学设计实验如下,完成表中空格(乙和丙同学对装置和试剂上进行了优化):
写出乙同学实验中D装置发生的化学方程式2NO2+Na2O2=2NaNO3.
(1)Na2O2作供氧剂时,主要与人呼出的CO2反应,写出该反应的化学方程式,并用双线桥标明电子转移的方向和数目
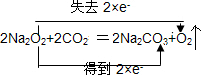 .
.(2)航空和水下作业有时也会产生污染性气体,某学习小组欲探究Na2o2能否完全吸收氮氧化物、硫氧化物等污染性气体,设计了如下装置(未画完):

【资料信息】①酸性条件下,NO和NO2都能与MnO4-(H+)反应生成NO3-和Mn2+
②稀硝酸与Cu反应缓慢 ③2NO+Na2O2=2NaNO2
请在答题卷方框内补充完整装置示意图,并做必要标注.补充装置的作用是检验污染气体是否完全被Na2O2吸收,同时可防止污染气体排放到空气中.
(3)该学习小组中甲、乙、丙三位同学设计实验如下,完成表中空格(乙和丙同学对装置和试剂上进行了优化):
| 实验学生 | 实验操作 | 现象与结论 |
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
7.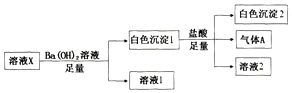 某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )
 某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )| A. | 气体A可能是CO2或SO2 | |
| B. | 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+ | |
| C. | 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+ | |
| D. | 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀 |
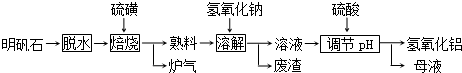

 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$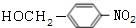 +NaCl.
+NaCl.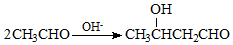 .
.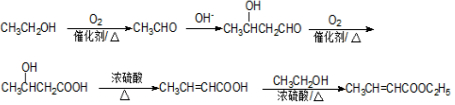 .
.