题目内容
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,W的单质是空气中体积分数最大的气体,W为N元素,Z最外层电子数等于最内层电子数,结合原子序数可知Z为第三周期的Mg元素;X、Y、Z的简单离子的电子层结构相同,设Y的最外层电子数为y,X的最外层电子数为x,由W与Y最外层电子数之和为X的最外层电子数的2倍,5+y=2x,x=6时y=7,则X为O,Y为F,以此来解答.
解答 解:由上述分析可知,W为N,X为O,Y为F,Z为Mg,
A.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z),故A正确;
B.Y为F,无正价,故B错误;
C.非金属性O>N,则X的气态氢化物比W的稳定,故C错误;
D.NO2只含共价键,MgF2只含离子键,化学键不同,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
8.在500g 0.2%的盐酸和500g 2%的盐酸中,分别加入2.3g钠,钠全部反应后,产生的气体( )
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
9.下列说法正确的是( )
| A. | 试纸在检测溶液时不需要湿润,而检测气体时必须湿润 | |
| B. | 焰色反应使用的铂丝通常可用稀硫酸清洗 | |
| C. | 碘水中的碘可以用酒精萃取 | |
| D. | 在实验室遇酸灼伤,用水洗后再用稀NaOH溶液浸洗 |
6.设NA为阿伏加德罗常数值,下列说法正确的是( )
| A. | 1molFe与过量稀HNO3反应,电子转移数为2NA | |
| B. | 120g由NaHSO4和KHSO3组成的混合物含硫原子数为NA | |
| C. | 标准状况下,22.4LCH2Cl2含氯原子数为2 NA | |
| D. | 0.3mol/LAl(NO3)3溶液中含A13+数小于0.3 NA |
3.下列实验操作、现象与所得结论一致的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射 | 溶液变红褐色,出现 丁达尔效应 | 产生了 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A. | A | B. | B | C. | C | D. | D |
1.已知热化学方程式:
C(金刚石,s)+O2(g)═CO2(g)△H1 ①
C(石墨,s)+O2(g)═CO2(g)△H2 ②
C(石墨,s)═C(金刚石,s)△H3=+1.9kJ•mol-1③
下列说法正确的是( )
C(金刚石,s)+O2(g)═CO2(g)△H1 ①
C(石墨,s)+O2(g)═CO2(g)△H2 ②
C(石墨,s)═C(金刚石,s)△H3=+1.9kJ•mol-1③
下列说法正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化成金刚石的反应是吸热反应 | |
| C. | △H3=△H1-△H2 | |
| D. | △H1>△H2 |
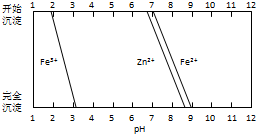 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为: .(不考虑空间构型)
.(不考虑空间构型)