题目内容
13.(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备.某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为Al3++4OH-=AlO2-+2H2O.
分析 (1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)铁和水蒸气反应生成四氧化三铁和氢气;
(3)白色沉淀最终转化为红褐色沉淀是氢氧化亚铁被空气中的氧气氧化生成氢氧化铁;
(4)向Al2(SO4)3溶液中加入了过量NaOH溶液,发生反应为铝离子生成氢氧化铝沉淀,沉淀氢氧化铝是两性氢氧化物溶于强碱生成偏铝酸钠.
解答 解:(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,则产生气泡的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)白色沉淀最终转化为红褐色沉淀是氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;
(4)向Al2(SO4)3溶液中加入了过量NaOH溶液,发生反应为铝离子生成氢氧化铝沉淀,沉淀氢氧化铝是两性氢氧化物溶于强碱生成偏铝酸钠,反应的总离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题考查了铝及其化合物性质、反应离子方程式书写、反应过程分析判断等,掌握基础是解题关键,题目难度不大.

| A. | 向K2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原K2CO3的物质的量之比为1:2 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是一部分为Al(OH)3沉淀,一部分以A1O2-形式存在于溶液中 | |
| D. | 加入A1放出H2的溶液中可能大量存在Fe3十、K十、C1一、NO3- |
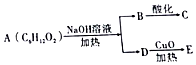
| A. | 13种 | B. | 9种 | C. | 8种 | D. | 10种 |
| X | Y | W | Q | |
| 10min | 1.0mol | 3.0mol | 1.0mol | 2.0mol |
| 20min | 0.5mol | 1.5mol | 2.0mol | 1.0mol |
| A. | X+2Y═2W+2Q | B. | 3X+Y+2W═2Q | C. | X+3Y+2Q═2W | D. | X+2Y+3Q═2W |
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 治理汽车尾气中NO和CO,可利用催化装置将NO与CO转化成CO2和N2 | |
| C. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ 2CuO CuO+H2SO4═CuSO4+H2O |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射 | 溶液变红褐色,出现 丁达尔效应 | 产生了 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A. | A | B. | B | C. | C | D. | D |
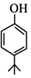 ,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式:
,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式: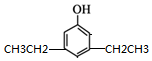 、
、 .
.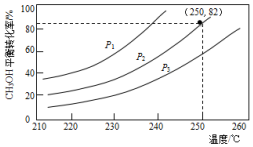 2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.
2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.