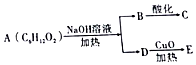
题目内容
14.向分别含1molNaOH和1molBa(OH)2的混合溶液中通入amolCO2,下列说法不正确的是( )| A. | 当a=l.0时,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当a=2时,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O | |
| C. | 当a=2.5时,反应的离子方程式为:OH-+CO2═HCO3- | |
| D. | 当a=1.75时,溶液中HCO3-与CO32-的物质的量之比为2:1 |
分析 向分别含1molNaOH和1molBa(OH)2的混合溶液中通入amolCO2,1molBa(OH)2优先反应生成碳酸钡沉淀和水,当氢氧化钡溶液反应完全后,1molNaOH再反应生成碳酸钠和水,当氢氧化钠反应完全后,碳酸钠再与二氧化碳反应,最后碳酸钡与二氧化碳反应,据此进行解答.
解答 解:A.a=1.0时,只有1molBa(OH)2参与反应生成碳酸钡沉淀,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O,故A正确;
B.当a=2时,1mol氢氧化钡完全反应消耗1mol二氧化碳,剩余的1mol二氧化碳恰好与1molNaOH反应生成碳酸氢钠,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O,故B正确;
C.1molNaOH和1molBa(OH)2的混合溶液中含有氢氧根离子的总物质的量为:1mol+1mol×2=3mol,若3mol氢氧根离子完全转化成碳酸氢根离子,需要消耗3mol二氧化碳,而二氧化碳只有2.5mol,说明最终还有3mol-2.5mol=0.5mol碳酸钡,即反应生成0.5mol碳酸钡、0.5mol碳酸氢钡和1mol碳酸氢钠,正确的离子方程式为:Ba2++6OH-+5CO2═BaCO3↓+4HCO3-+H2O,故C错误;
D.当a=1.75时,1mol氢氧化钡完全反应消耗1mol二氧化碳,剩余的0.75mol二氧化碳再与1molNaOH反应生成碳酸钠,反应后还剩余0.25mol二氧化碳继续0.25mol碳酸钠反应生成0.5mol碳酸氢钠,所以最终溶液中含有0.5mol碳酸氢钠、0.25mol碳酸钠,溶液中HCO3与CO32-的物质的量之比为2:1,故D正确;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,根据反应物过量情况正确判断反应产物为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及逻辑推理能力.

| A. | 13种 | B. | 9种 | C. | 8种 | D. | 10种 |
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 治理汽车尾气中NO和CO,可利用催化装置将NO与CO转化成CO2和N2 | |
| C. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ 2CuO CuO+H2SO4═CuSO4+H2O |
| A. | 试纸在检测溶液时不需要湿润,而检测气体时必须湿润 | |
| B. | 焰色反应使用的铂丝通常可用稀硫酸清洗 | |
| C. | 碘水中的碘可以用酒精萃取 | |
| D. | 在实验室遇酸灼伤,用水洗后再用稀NaOH溶液浸洗 |
| A. | 共价化合物的熔沸点都比较低 | |
| B. | 氢的三种核素可组成6种水分子 | |
| C. | H2O分子比H2S分子稳定的原因,是H2O分子间存在氢键 | |
| D. | SiO2和CaCO3在高温下反应生成CO2气体,说明硅酸的酸性比碳酸强 |
| A. | 1molFe与过量稀HNO3反应,电子转移数为2NA | |
| B. | 120g由NaHSO4和KHSO3组成的混合物含硫原子数为NA | |
| C. | 标准状况下,22.4LCH2Cl2含氯原子数为2 NA | |
| D. | 0.3mol/LAl(NO3)3溶液中含A13+数小于0.3 NA |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射 | 溶液变红褐色,出现 丁达尔效应 | 产生了 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. |  | D. |  |
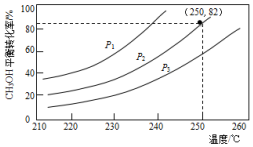 2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.
2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.