题目内容
11.为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中.如图所示仪器及药品试回答:?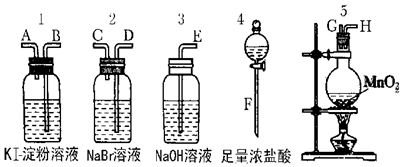
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接D、C接B、A接E.
(2)实验开始后装置5中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)装置3的作用是溶液变蓝反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O.
(4)装置1中产生的现象是溶液变蓝 反应的离子方程式为Cl2+2I-═I2+2Cl-.
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2.
分析 5为制备氯气装置,在加热条件下MnO2与浓盐酸反应可制取Cl2,生成氯气通入2中,氯气与NaBr发生置换反应生成溴,通入1中与KI反应生成碘,可观察到1中溶液变蓝色,3为尾气处理装置,防止污染空气,由此实验可知卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2,以此解答该题.
解答 解:(1)先制取氯气,然后将氯气通入NaBr溶液、再通入KI溶液检验氯气的强氧化性,氯气有毒不能排空,否则会污染大气,所以最后连接尾气处理装置,检验装置中导气管遵循“长进短出”原则,所以连接顺序是F接G、H接D、C接B、A接E,
故答案为:D;C;B;
(2)实验开始后装置5中反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)二氧化硫有毒,不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以装置3的作用是吸收未反应完的Cl2,防止污染空气,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:吸收未反应完的Cl2,防止污染空气;Cl2+2OH-═Cl-+ClO-+H2O;
(4)氯气能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,所以看到的现象是溶液变蓝色,化学反应离子方程式为:Cl2+2I-═I2+2Cl-,
故答案为:溶液变蓝;Cl2+2I-═I2+2Cl-;
(5)实验装置1,2的现象说明氯气和NaBr溶液、KI溶液发生反应,Cl2+2I-═I2+2Cl-,Cl2+2Br-=Br2+2Cl-,反应中Cl元素化合价由0价变为-1价、Br或I元素化合价由-1价变为0价,所以氯气作氧化剂、溴或碘单质作氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以Cl2的氧化性大于Br2>I2,已知溴离子的还原性弱于碘离子的还原性,说明Br2的氧化性大于I2,由此得出同主族元素随着原子序数的递增,元素非金属性逐渐减弱,单质氧化性逐渐减弱,Cl2>Br2>I2,
故答案为:Cl2>Br2>I2.
点评 本题以卤族元素为例考查非金属元素性质递变规律,为高频考点,题目涉及气体的制取、性质检验、尾气处理,明确实验先后顺序是解本题关键,同时还考查学生实验操作能力及思维的缜密性,题目难度不大.

| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
| A. | 食物腐败 | B. | 氨气液化 | C. | 海水晒盐 | D. | 石油分馏 |
| A. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶 |